この講義の内容は動画として下記のYouTubeサイト(生命科学講義)で視聴可能です
https://youtu.be/knuzBNJAay4
1. この講義は下記のような内容を含んでいます。18枚の図を含みます。
1. Initiator tRNAに付加されているアミノ酸とelongator tRNAに付加されているアミノ酸。
2. 翻訳開始AUGコドン上流配列の特徴。
3. 翻訳開始30S Small subunit複合体の形成
4. A-siteへのaminoacyl-tRNAの侵入とLarge subunitのシフト
5. EFG-Tu・GTPの加水分解によるSmall subunitのシフトとHybrid siteの解消。
6. Release Factorによる終止コドンの認識と新生ペプチド鎖の放出,大小リボソームの分離。
Key words: Initiator tRNA, Elongator tRNA, fMet,Shine-Dalgarno 配列, IF-1, IF-2, IF-3, EF-Tu・GTP, EF-G・GTP,翻訳の速度と精度,Hybrid site, Release Factor, eRF1, RF-1, RF-2
2. 翻訳会誌複合体の形成

この動画では、細菌の翻訳のメカニズムについてStep by Stepで説明をしていきます。では始めます。
まずは,30S Small ribosomeにおける翻訳開始複合体の形成について説明をします。
3. 真正細菌などのInitiator tRNAに付加されるアミノ酸: fMet
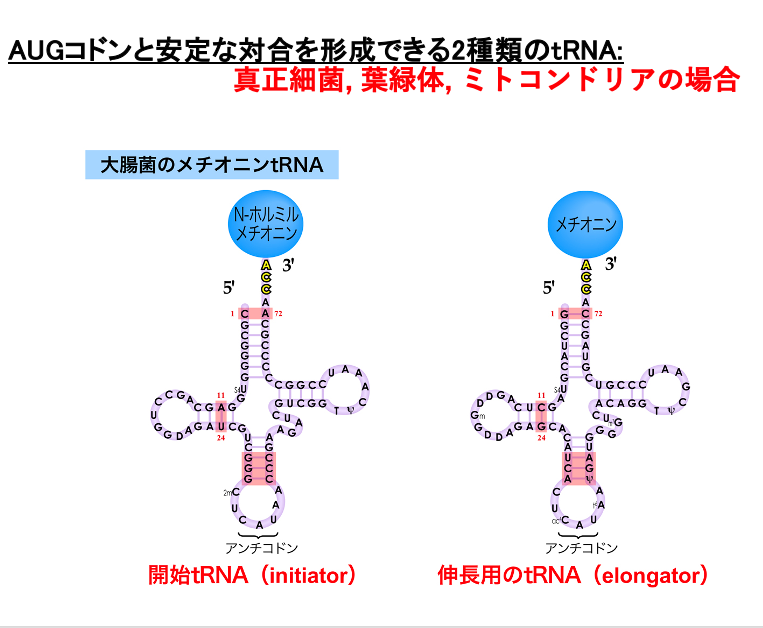
翻訳開始のコドンはAUGですが,この翻訳開始AUGコドンに対合するtRNAに付加されているアミノ酸は,真核生物・古細菌と真正細菌・オルガネラでは異なっています。また,AUGは翻訳開始専用のコドンではなくOpen Reading Frameの途中にも出現します。
翻訳開始AUGコドンに対合するtRNAはinitiator RNAと呼ばれ, それ以外のAUGコドンに対応するtRNAはelongator tRNAと呼ばれます。
真正細菌や葉緑体,ミトコンドリアにおいてinitiator tRNAの3 prime末端には,formylmethionine (fMet)が付加されています。 一方,elongator tRNAにはメチオニンが付加します。
4. 真核生物や古細菌のInitiator tRNAに付加されるアミノ酸: Met
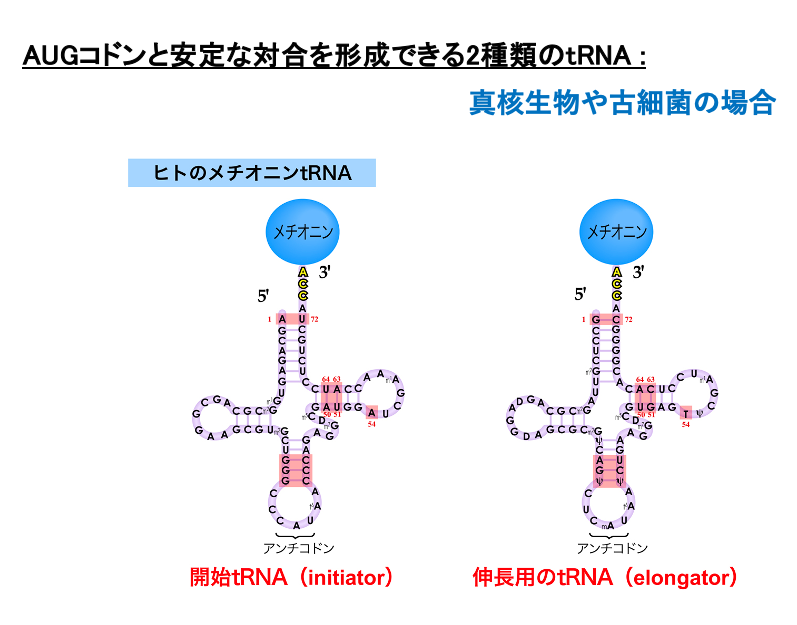
一方,真核生物や古細菌では翻訳開始AUGコドンに対応するinitiator tRNAにはformylmethionineではなく,メチオニンが付加されています。また,elongator tRNAにも同じくメチオニンが付加されます。
5. AUG コドンが翻訳開始コドンとなるための条件
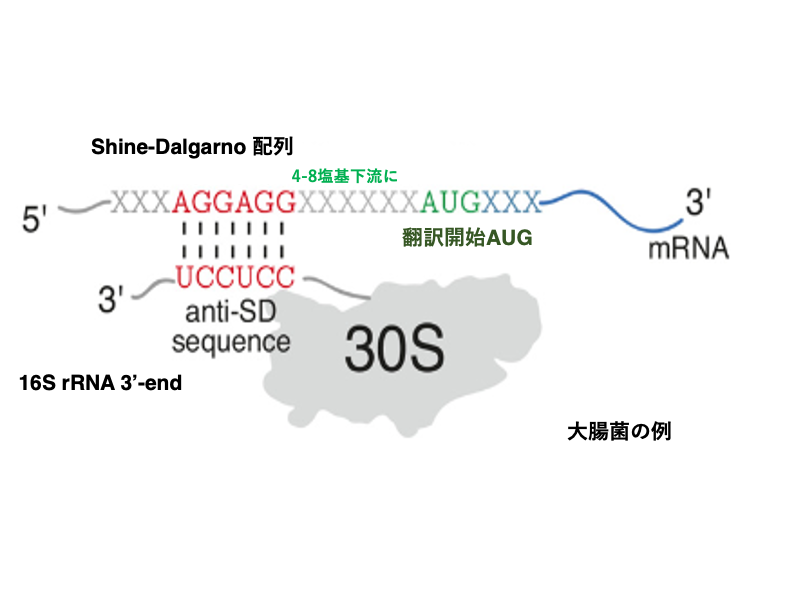
翻訳開始に使用されるAUGコドンには,Open Reading Frameの途中に出現するAUGと比較して以下のような特徴があります。
翻訳開始AUGコドンでは,そのmRNAの4 – 8塩基上流にシャイン・ダルガノ配列 (Shine-Dalgarno sequence)が存在します。Shine-Dalgarno sequenceというのは,30S ribosome subunitに含まれている16S ribosome RNAの3 prime 末端側の6-7塩基と相補的な配列を指します。大腸菌の場合には,3’-AGGAGGU-5’配列がそれに相当します。
16S ribosome RNA の3 prime末端近辺にあるAnti- Shine-Dalgarno sequenceがmessenger RNA側にあるShine-Dalgarno sequenceと水素結合を形成することで,リボソームsmall subunitへのmRNA付着が安定化すると考えられます。一方,Open Reading Frameの途中に出現するAUGの上流には,このようなShine-Dalgarno sequenceは見つかりません。
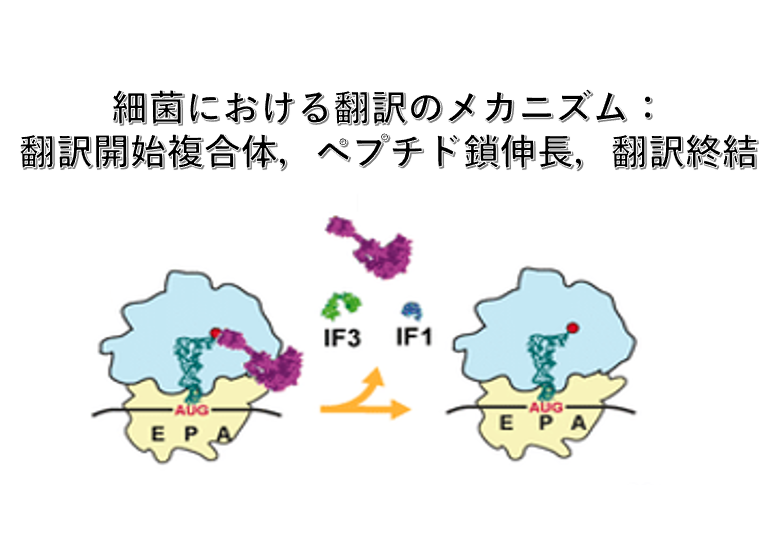
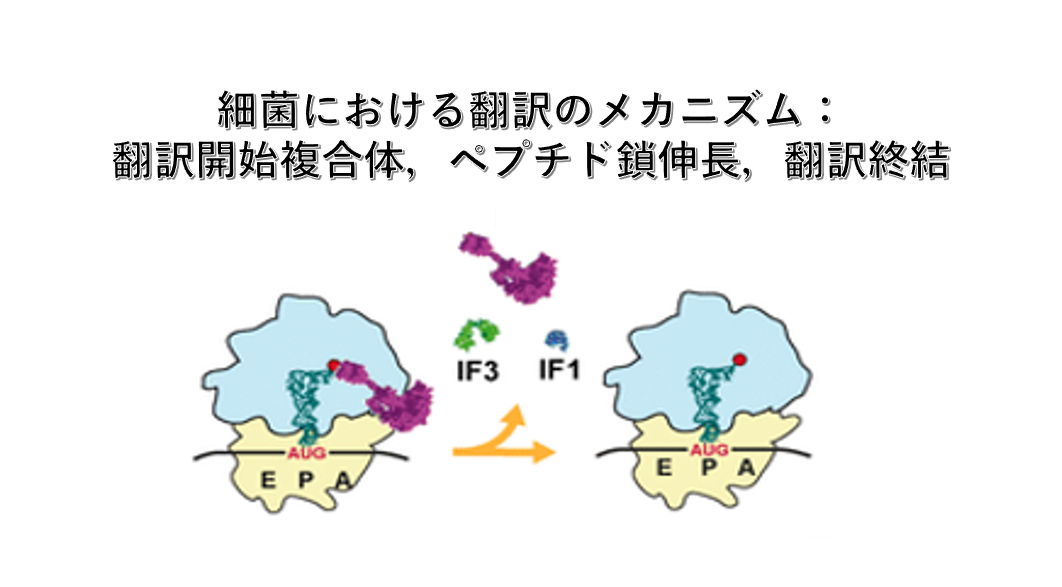
6. 30S Small ribosome 翻訳開始複合体
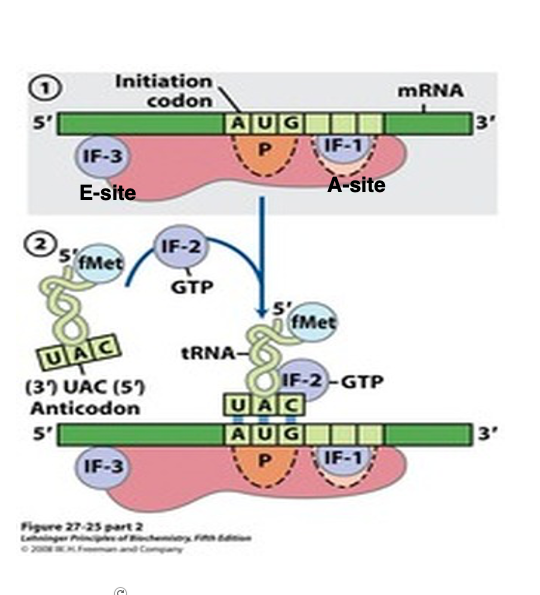
翻訳開始に先立って,Small subunitはLarge subunit から解離した状態であることが必要です。
解離したSmall subunitの中にある16S rRNAのanti-Shine-Dalgarno 配列付近にはInitiation Factor-3 (IF-3)が付着します。IF-3がSmall subunitに付着することにより,mRNAがSmall subunitに呼び込まれ,またmRNAが持つShine-Dalgarno 配列と16S rRNAのanti-Shine-Dalgarno 配列の相互作用などにより,Small subunit のP-siteに翻訳開始AUGコドンが配置されるようになります。また,A-site付近に付着しるInitiation Factor-1(IF-1)もIF-3と同様にSmall subunitへのmRNAの結合を促します。
この状態になると,formylmethionine (fMet)を付加したinitiator RNAがIF-2 ・GTP複合体と結合した3量体を形成して,翻訳開始AUGコドンに安定的に結合できるようになります。
7. Initiator tRNAのset upと50S Large subunitの会合
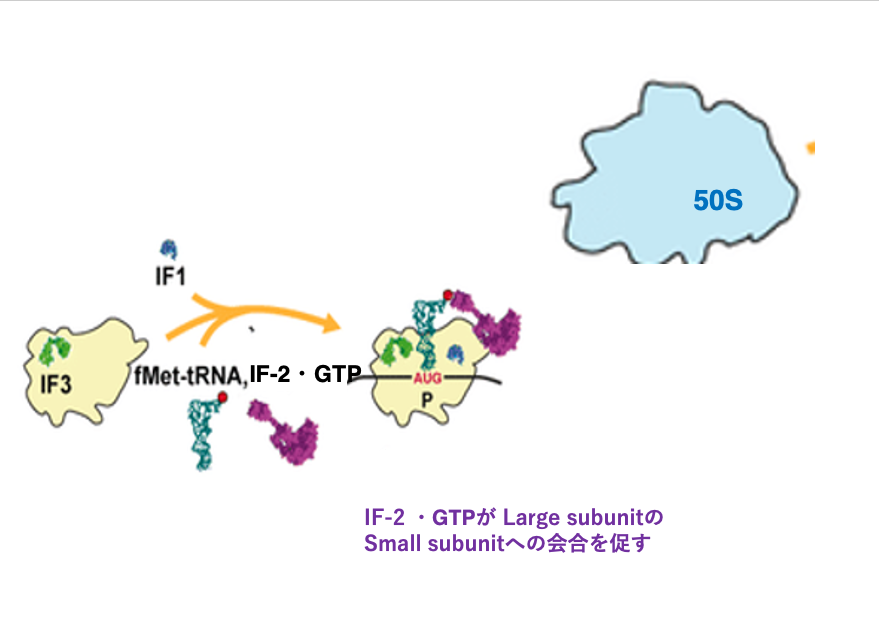
このように翻訳開始tRNAのset upが完了すると,Large subunitがSmall subunit上に呼び込まれます。
8. 70S リボソーム複合体の形成
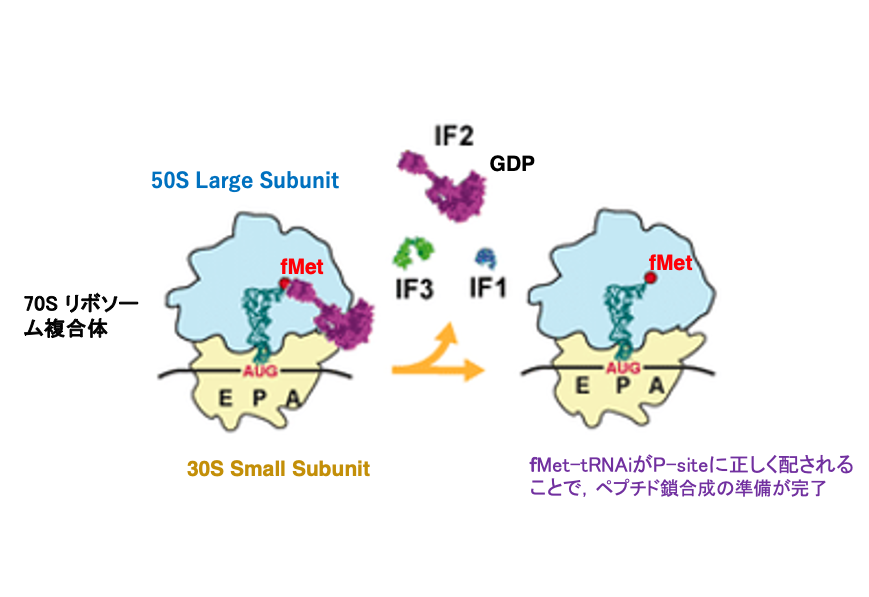
Large subunitがSmall subunitに会合すると,IF-2 ・GTP複合体のGTPがGDPに変化し,それによりIF-2 ・GDP複合体とIF-1が離脱します。また,少し遅れてIF-3も離脱します。
この状態になると,リボソームはタンパク合成開始の準備が完成したことになり,空のA-siteにaminoacyl-tRNAを受け入れることができます。
9. 翻訳開始のためのリボソームのセットアップ過程
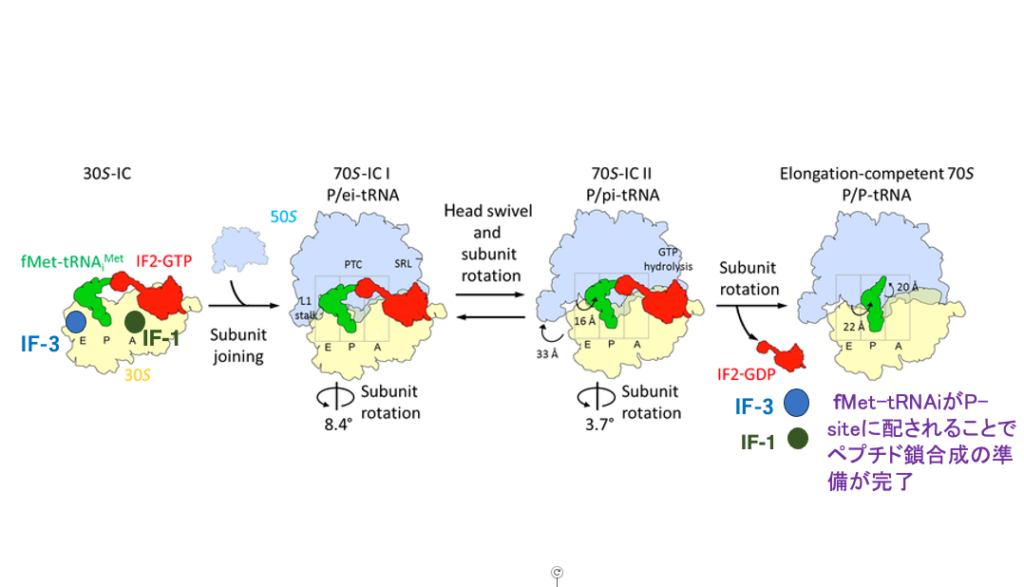
一連の流れを別の図で復習しましょう。mRNAの翻訳開始コドンがSmall subunitのP-siteに配置され,そこにformylmethionine を付加したinitiator RNAを呼び込まれ,最後にLarge subunitが呼び込まれます。翻訳開始複合体のset up のために使用されたIF-1, IF-2, IF-3分子はリボソームから離脱していきます。
10. Aminoacyl tRNAのA-site への侵入
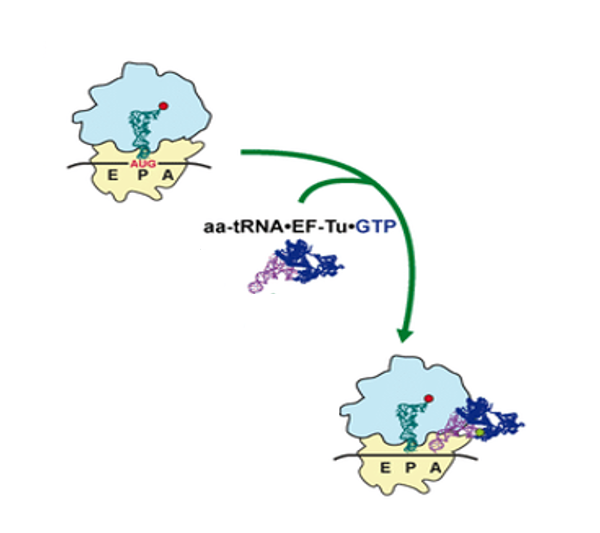
ここからは,新生ペプチド鎖の伸長反応について解説をしていきます。
Initiator-tRNAがP-siteにあり,その右側のA-siteにはaminoacyl-tRNAがランダムにアクセスしてきます。aminoacyl-tRNAは,単独ではなくElongation Factor Tu・GTPと複合体を形成して,ランダムにA-siteに運ばれてきます。
11. 適正なaminoacyl-tRNAがA-siteに侵入した場合の反応
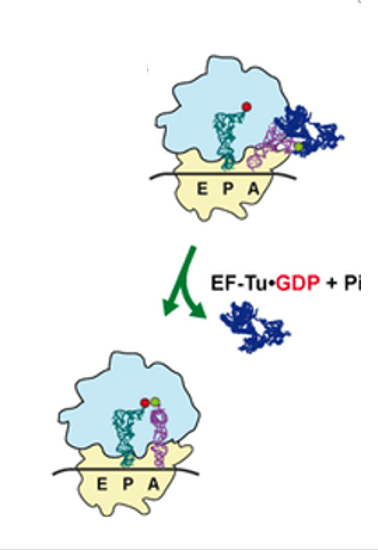
A-siteにaminoacyl-tRNAが入ると,そのアンチコドンがコドンと安定な水素結合を形成しているかがチェックされます。安定な結合が形成されると,aminoacyl-tRNA を運んできたEF-Tu ・GTPのGTPがGDPに加水分解されます。
そのエネルギーによりEF-Tuの立体構造が変化して,EF-Tu・GDP複合体はリボソームから排出されます。
12. アミノ酸転移とLarge subunit の3塩基シフト
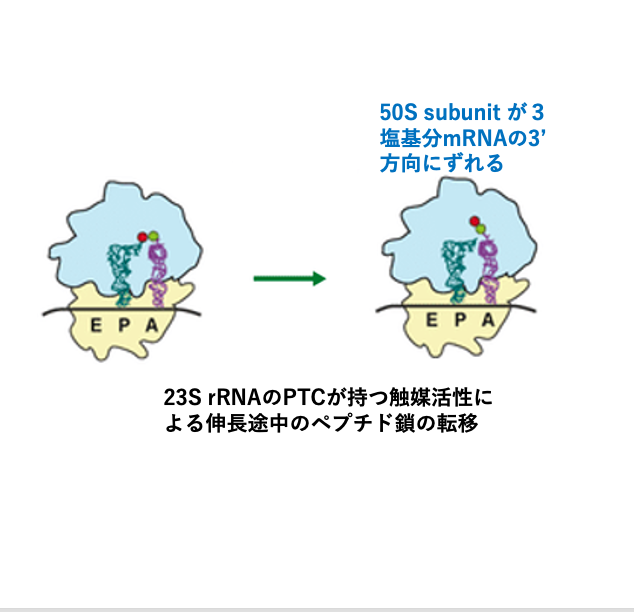
EF-Tu・GDPがaminoacyl tRNAから離脱すると,P-siteの開始tRNAに付加されているformylmethionineがA-siteのtRNAが運んできたアミノ酸に転移され,dipeptideが形成されます。この時に,Large subunitのみが3塩基分だけ3 prime方法にシフトします。
このアミノ酸の転移反応は,アミノアシル結合が加水分解される時に放出されるエネルギーを利用して起こります。この反応を触媒するのが,Large subunit内の23S rRNA内にあるPeptidyl Transferase Center (PTC)です。
13. EF-Tu・GTP複合体のリサイル利用
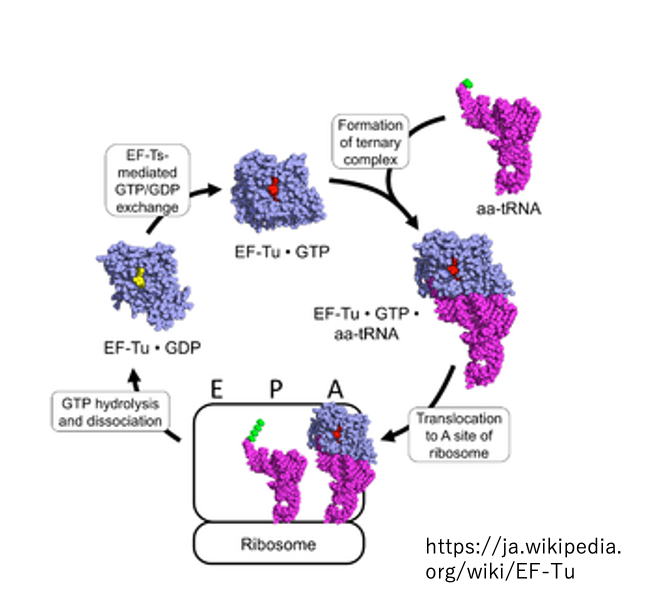
A-siteにaminoacyl-tRNAを運んでくるのは,EF-Tu・GTP複合体です。アミノ酸を運び終えて,リボソームから離脱したEF-Tu・GDP複合体は,EF-Tu・GTPに戻されて再利用されます。Initiator tRNAに限り,それをP-siteに運んでくるのがIF-2・GTP複合体です。
14. リボソームにおけるHybrid なE-,A-,P-siteの形成
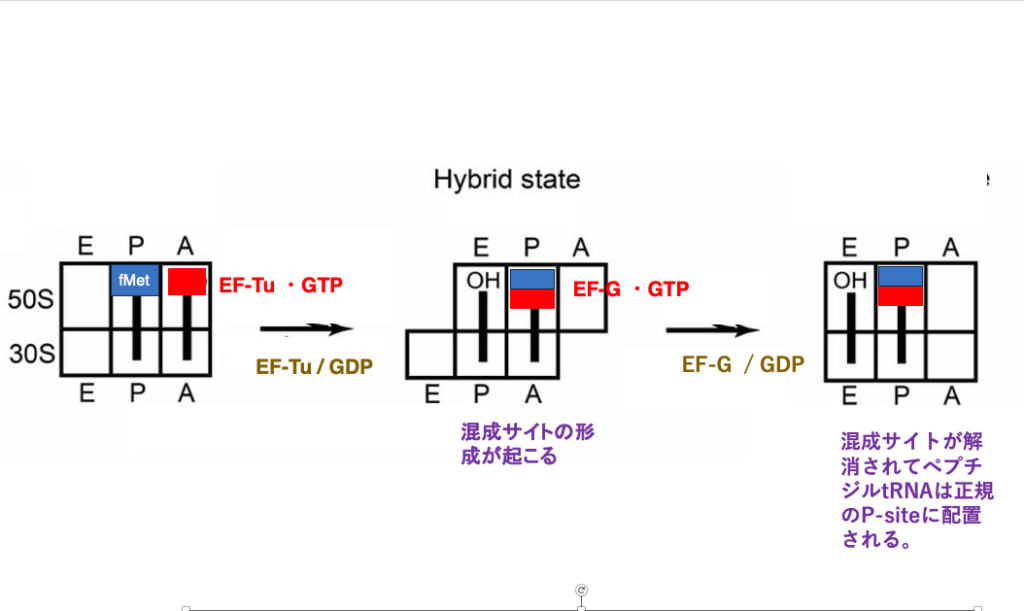
この図は,アミノ酸転移と同時にLarge subunitが3塩基分3-prime方向にずれた状態のリボソームを示しています。 この時,リボソームのE-site, P-site, A-siteは,Small subunitとLarge subunitで空間の特徴が一致しない混成サイトになります。
既にInitiator tRNAは,formylmethionineを離してしまっていますから,このtRNAの3-prime末端はOHになっており,それはLarge subunit のE-siteに入っています。 一方で,Small subunitは動いていないので, そのアンチコドンステムはP-siteに残っています。
同様にdipeptideを付加しているtRNAについても,その3 prime 末端のaminoacyl-stemはLarge subunitのP-siteにあるのに対して,アンチコドンステムはSmall subunit のA-siteに入ったままでます。
次に,空になったLarge subunitのA-siteに Elongation Factor G (EF-G)・GTP複合体が入ってきます。このGTPがGDPに加水分解された時のエネルギーにより,Small subunitが3塩基分3 prime 方法にシフトすることで,Large subunitとSmall subunitの間で形成されていたHybrid siteが解消されます。
Small subunitの移動が完了すると 正規のE-siteには,アミノ酸を離してしまったtRNAが,正規のP-siteにdipeptide が付加されたtRNAが配置されます。E-siteのinitiator-tRNAは,やがてリボソーム外に排出されます。
15. ペプチド鎖伸長反応途中のリボソームの動き
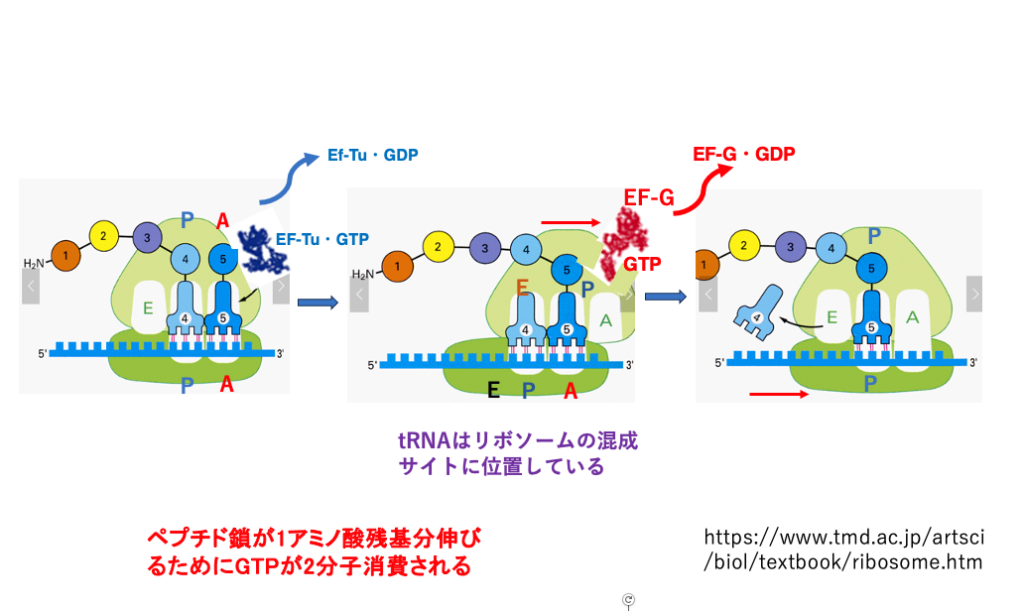
この図で,でもう一度説明をします。この図では,ペプチド酸が伸びつつある翻訳途中のリボソームを示しています。
左側の図では,A-siteにaminoacyl tRNAとEF-Tu・GTP の複合体が侵入したところを示しています。 コドン、アンチコドンの対合が正しいことが確認されると、GTPの加水分解が起こり,EF-Tu ・GDPはリボソームから離脱します。
それと同時に,Large subunit のみが3塩基分,3 prime方向にずれて,混成サイトが形成されます。空になったLarge subunit A-siteにはEF-G・GTP複合体が入ってきます(中央の図)。このGTPが加水分解されるエネルギーにより,30S Small subunitが3 prime方向にずれることで混成サイトは解消されます(右図)。
その結果,ペプチド鎖を転移し,正規のE-siteに配置されることになった空のtRNAはリボソームから脱離します。
ペプチド鎖が1アミノ酸残基伸びるために,EF-Tu・GTP とEF-G・GTPの持っているGTPが合計で2分子消費されるということになります。この他にアミノアシル結合の持つエネルギーが消費されています。
16. ペプチド鎖伸長の速度と精度

ペプチド鎖の伸長速度は,真核生物ではおよそ1秒間に2アミノ酸残基,原核生物では,もっと早くて1秒間に20アミノ酸残基ほどです。
また,そのエラー率は低く,真核,原核を問わず,1万アミノ酸伸長につき1個くらいです。99.99%の精度ということになります。
17. 翻訳の終了メカニズム
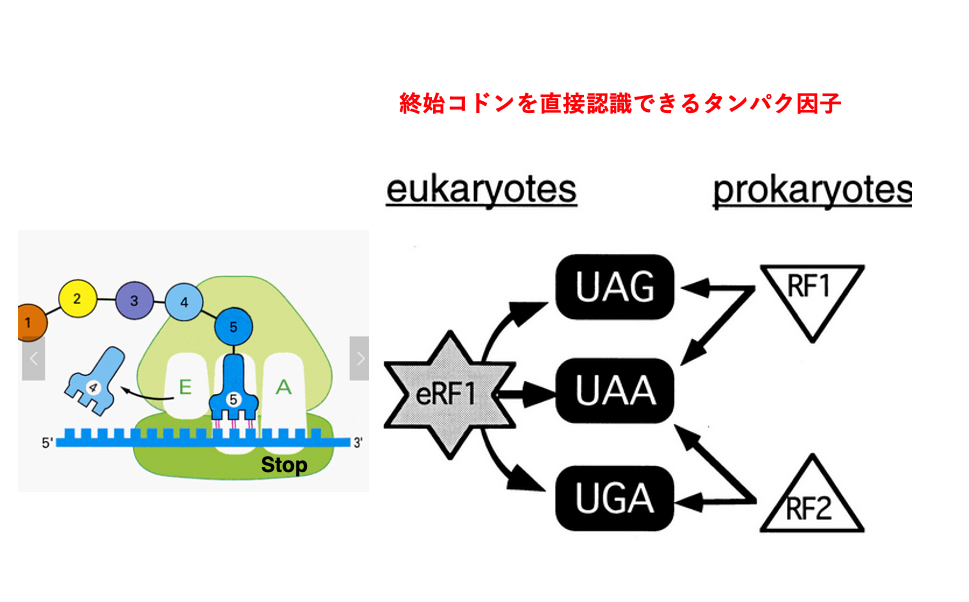
次に、翻訳終止のメカニズムについて説明をしていきます。 stop codonは、UAG、UAA、UGAと3つありますが、 このstop codonと安定な水素結合ができるアンチコドンを持つようなtRNAは、 細胞には存在しません。 その代わり、これらのstop codonに結合ができるタンパク因子,Release Factor (RF)があります。細菌の場合は、RF1はUAGとUAAを認識することができ、 RF2はUAAとUGAを認識することができます。
一方,真核生物ではeRF1と呼ばれるRelease Factorが, 3種類のstop codon全てと結合することができます。 eRF1もタンパク分子ですが,その立体構造はtRNAに類似していることが知られています。一方で,真正細菌のRF1/RF2の立体構造はtRNAとの類似性が見られません。このことから,eRF1とRF1/RF2は,翻訳の終結という同じ作用を担っているタンパクですが,進化的な連続性はないと考えられています。
18. 新生ペプチド鎖の放出とリボソーム・サブユニットの分離
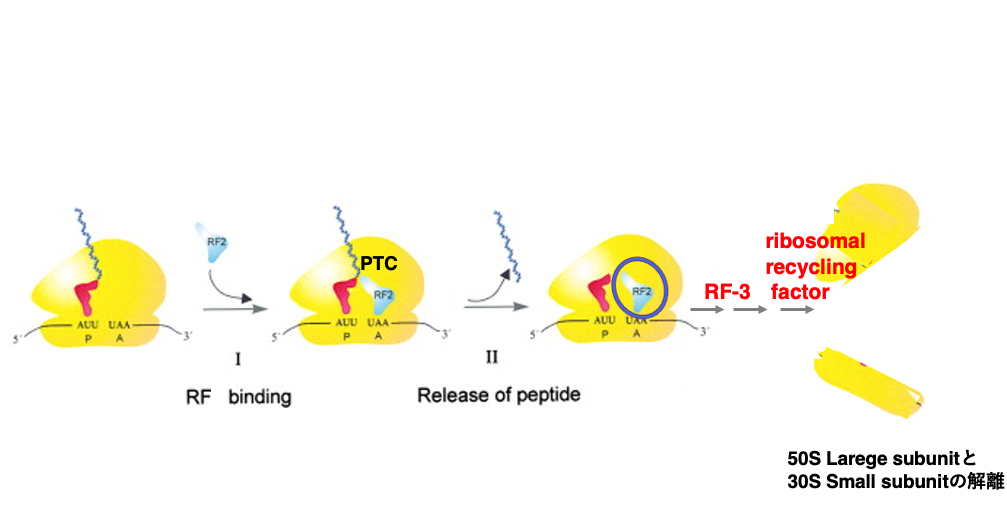
翻訳が進んでいくとA-siteにstop codonが入ってきます。この時,P-siteには、長く伸びた新生ペプチド鎖をつけたtRNAが配置されています。A-site のstop codon に対しては,適切なRelease Factorが結合します。Release FactorはLarge subunit内の23S RNAにあるPeptidyl Transferase Center (PTC)に働きかてけ,新生ペプチド鎖とtRNA間のアミノアシル結合を加水分解して,切り離す反応を促します。
切り離された新生ペプチド鎖は,リボソームのLarge subunit内にある排出路から出ていくことになります。その結果,リボソーム内にはペプチド鎖を持っていない tRNAとRelease Factorが残ります。
リボソームが再び翻訳を開始するためには,tRNAとRelease factorが取り除かれて, Large subunit とSmall subunitに解離する必要があります。その反応にはRelease Factor 3やribosomal recycling factorが関与しています。
細菌における翻訳の メカニズムを説明しました。 以上です。
コメント