この講義の内容は下記のYouTube サイト(生命科学を専攻する学生のための分子生物学講義)でも視聴できます
https://youtu.be/HxZRC7WyhzY

この講義は以下の内容を含みます。
1. 2つのプリオンタンパクの立体構造
2. パプアニューギニアのクールー病
3. 変性プリオンタンパクによる発症の伝達
4. プリオン病の発症メカニズム
5. 狂牛病が蔓延した原因
6. 酵母にあるプリオン様タンパク
Key words: プリオン, クロイツフェルト・ヤコブ病, クールー病, アミロイド斑, 牛海綿状脳症, BSE , 狂牛病,肉骨粉
1. 様々な哺乳類におけるプリオン病

プリオン病について解説をしていきます。2つの安定なタンパク質の立体構造が存在することによって,発症し,同種の個体間で病状が伝達し,場合によっては種間の壁を越えて病状が伝達される病気です。
この表には、脊椎動物で知られているプリオン病を表にしました。
ヒトにおけるプリオン病は,クロイツフェルト・ヤコブ病(Creutzfeldt‐Jakob disease, CJD)という名称が一般的に使用されます。またニューギニアの一部の地域で発症しクールー (Kuru)病と呼ばれていた風土病も,今ではクロイツフェルト・ヤコブ病であったことが分かっています。
また,プリオン病は羊ではスプレー病,牛では海綿状脳症,俗に狂牛病やBSEと呼ばれ、世界中を震撼させました。また,シカ,ミンク,ネコなどの動物でもプリオン病を発症します。
2. タンパクの立体構造の原則:他よりも格段に低い唯一の立体構造
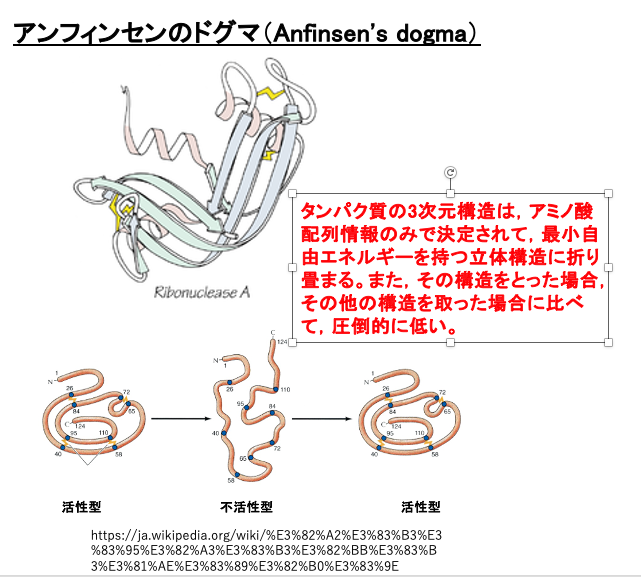
まずは、タンパクの3次元構造の折り畳みについて、一般的なことを復習しておきたいと思います。
一般にアンフィンセイのドグマ (Anfinsen’s dogma)と呼ばれますけれども、タンパクはそのアミノ酸配列が決まれば、 理想的な環境条件下ではアミノ酸配列に依る側鎖間の相互作用を介して、最小自由エネルギーを持つ立体構造に折り畳まれる、と考えられています。
また、その時の立体構造というのは、他の立体構造と比べて 格段に低いエネルギーを持つような構造となるように,アミノ酸配列は進化的に選び抜かれてきたと考えられています。
3. 正常なプリオンと変性プリオンの立体構造
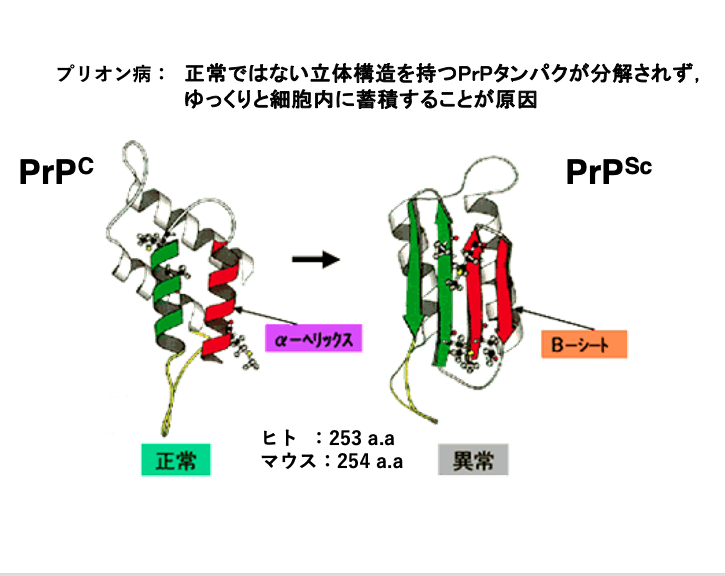
プリオン病では正常ではない立体構造を持つプリオンタンパク,PrPScというふうに表示されますが、このプリオンタンパクが分解されずにゆっくりと細胞内に蓄積することが原因で起こるということが現在では知られています。Scというのは,羊におけるプリオン病が体を柵なでに擦りつける(scrape)動作を伴うことから,”scrapie“と呼ばれていることに起因しています。
左側の図は正常な立体構造を持つプリオンタンパクで、PrPCと表示されます。”C”は,“cellular prion protein”から付けられた記号です。
異常な立体構造を持つプリオンタンパクは,何らかの原因で、正常なプリオンタンパクの2つのαhelix(左図の緑色と赤色)がβsheetに変換されることで生じた構造異常タンパクです。ヒトのプリオンタンパク質は,253個のアミノ酸から構成された27,000ダルトンの比較的小さなタンパクです。
4. 変性プリオンの蓄積によるアミロイド班の形成
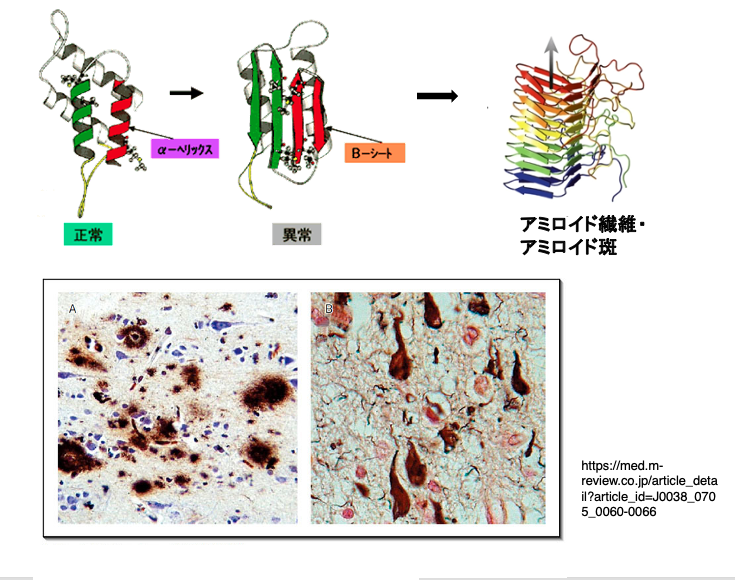
構造異常を起こしたプリオンタンパクが凝集することによって アミロイド繊維またはアミロイド斑が形成されます。変性プリオンのβ sheet同士が相互作用により,凝集することによって アミロイド班またはアミロイド繊維と呼ばれる凝集タンパク塊が形成されます。 プリオンタンパクは,もともと神経系の細胞において多く発現されているタンパクなので,変性タンパクが蓄積する場合も,脳神経系の組織で顕著に起こります。また,一旦,変性タンパクの蓄積がスタートすると,途中で中断させることはなく,最終的には個体を死に至らせるということになります。
5. パプア・ニューギニアの風土病:クールー病
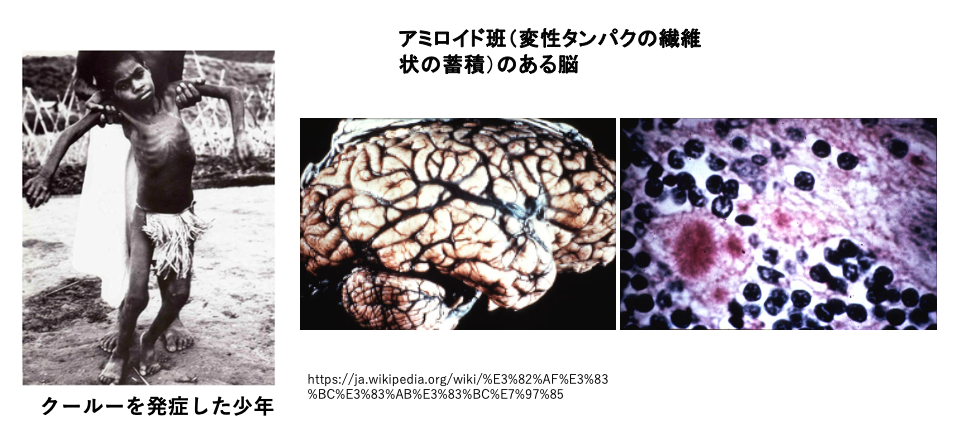
プリオン病の発症のメカニズムが明らかにされるまでの過程を解説していきます。
今ではプリオン病として認識されていますが、 1950年代にパプア・ニューギニアのフォレ族がかかる神経系の風土病(特定の地域や住民で発生する病気)として発見されました。この風土病に作られた名前はクールー病でした。写真の少年はクールー病にかかっていて、うまく歩くことができません。
また当時、フォレ族において患者数は2584名いたというふうに記録されていますが、 そのうち成人女性が70%、成人男性は非常に少なくて10%、子どもは20%となっています。成人では女性の比率が高く,男性が少ないという特徴があります。今日では,クールー病の原因がクールー病を発症したヒトの肉を,宗教的な意味合いから,主として女性が食べるというフォレ族の慣習に因ることが分かっています。
6. クールー病を発症させる物質:核酸を含まないタンパク?
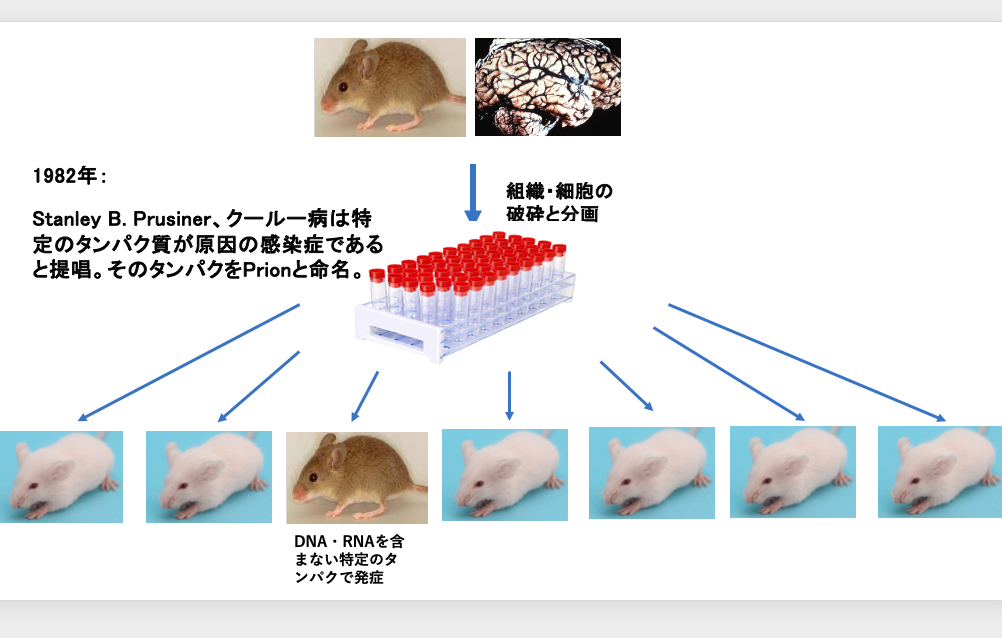
クールー病の発症のメカニズムについて研究が行われることになりました。
マウスでもクールー病と同様の病状を発している事例が見つかりましたので、主としてマウスを用いた実験が行われました。クールー病のマウスから脳組織を取り出し、その細胞を粉砕分割して,タンパク,核酸,脂質などの成分に分離後、各成分を正常なマウスに与えます。
その結果,長い間の潜伏期間を経て、低頻度ではありますがクールー病を発症するマウスが現れる事が実験的に分かりました。
このような実験を通じて、1982年にスタンレイ・プルシナー(Stanley Prusiner)は、 クールー病は特定のタンパクが原因の感染症であると提唱し、またその特定のタンパクをプリオンと命名しました。
7. 第2染色体上にコードされているプリオンタンパク

その後の研究で、プリオンタンパクをコードするような遺伝子、PRNP遺伝子は、ヒトでは第2染色体上にあるということが分かりました。
しかし、マウスにおいて,プリオン病を発症した個体のプリオン遺伝子の配列は、正常な個体のものと同一であることから、DNA配列の突然変異がプリオン病の原因ではないということが分かりました。
更にプリオン遺伝子を欠損しているノックアウトマウスに、変性プリオンタンパクを脳内に直接導入しても、餌として接種させても、プリオン病は発症しないということが明らかにされました。
8. 核酸を含まないタンパク質が感染の原因物質?
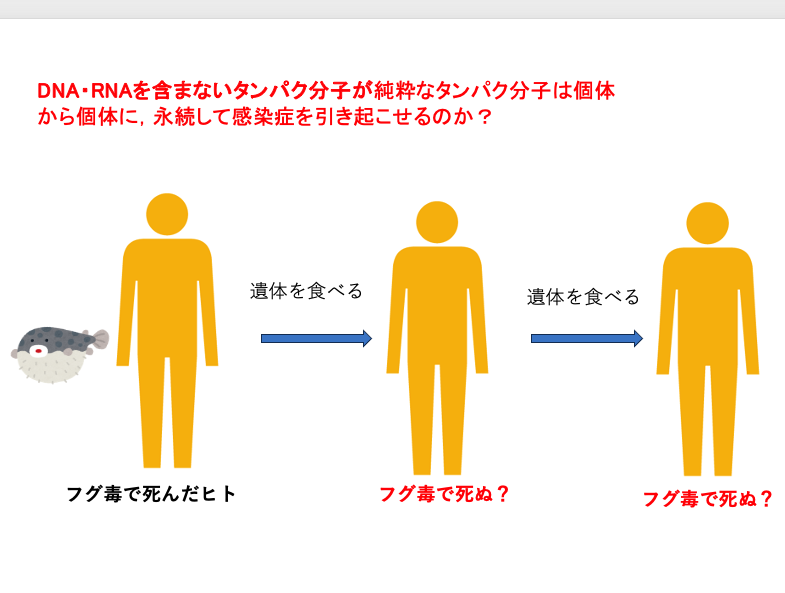
このような実験結果に、研究者は非常に困惑することになりました。DNAやRNAのような遺伝物質を含まない純粋なタンパク質がプリオン病の原因であり,そのタンパクが感染源となり,感染を他の個体に広げることができるというのは,それまでの分子生物学では,うまく説明することができないからです。
例えば、誤って毒フグを食べて、フグ毒により亡くなった人がいるとします。このフグ毒によって亡くなった人の遺体の一部を、 食べたとしても、おそらくこの人はフグ毒によって,死ぬことはないだろうと思われます。
仮に死亡したとしても、 フグ毒で死んだ人を食べて死んだ人を,さらに誰かが食べたて,死ぬというような連鎖は,単純なタンパク毒では考えられないからです。それは,ヒトからヒトに移行する間で毒素が希釈されるからですね。細菌やウイルス感染のような,遺伝子を持つ増殖性の因子が原因なら,個体から個体に移行しても,新たに感染した個体内で増殖するので,無限に個体から個体に原因物質が薄まることなく感染を広げることができますが, 純粋なタンパクが 連続して長期間にわたり、 個体から個体に感染性を引き起こすメカニズムを思いつかないからです。
9. 変性プリオンタンパク質が個体から個体に病気を伝達できるメカニズム
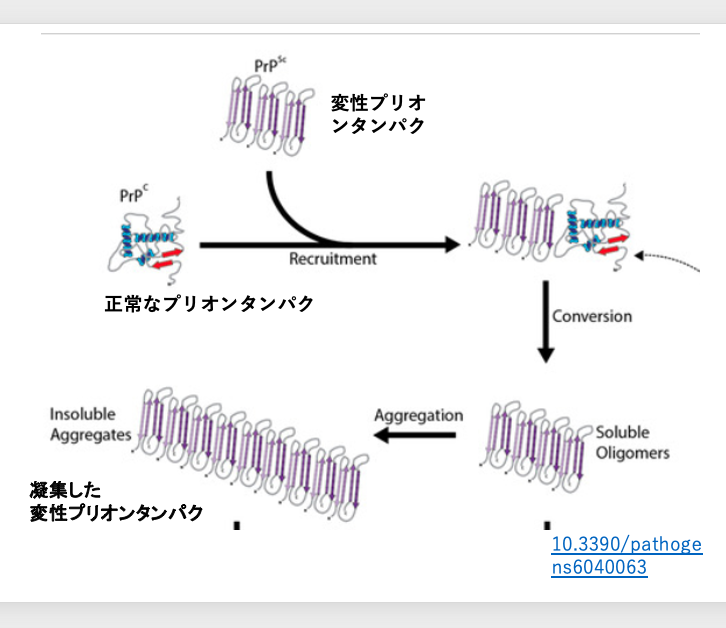
この問題を解決すべく、いろんな分野の研究者が議論し仮説が映出されました。
変性したプリオンタンパクが起点物質となって、既に存在している正常なプリオンタンパクに働きかけて、 その立体構造を変性させてしまうというモデルです。
このモデルですと、正常な遺伝子から正常な立体構造を持つプリオンは常に供給されていますから、変性したプリオンが1分子生体内に導入されれば、変性プリオンは徐々に数を増して細胞内に蓄積していくことになります。
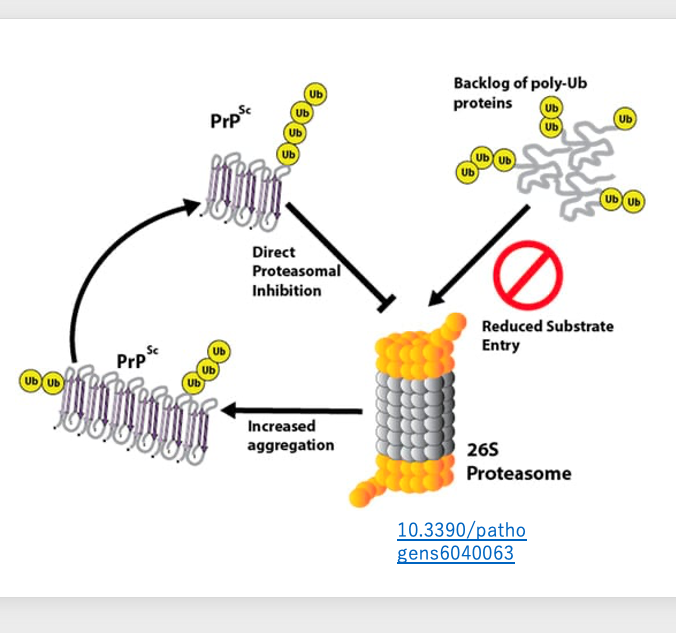
一般に,変性タンパクには短いペプチド鎖であるユビキンが付加されて,プロテオソームにおいて分解されることになります。しかし,変性プリオンはプロテオソームに結合して、その機能を阻害してしまうということが分かりました。
したがって、変性プリオンがあるとプリオン以外の変性タンパクについてもプロテオソームで分解されにくくなります。そのため,細胞内ではますます変性したタンパクが蓄積され、やがて変歩行困難などを引き起こします。これがプリオン病の発症メカニズムです。潜伏期間は長く,短くても8年から10年と考えられています。また,発症後の致死率は100%で,発症後1年程度で死亡することになります。
10. 変性プリオンタンパクの難分解性
一般に,変性タンパクには短いペプチド鎖であるユビキンが付加されて,プロテオソームにおいて分解されることになります。しかし,変性プリオンはプロテオソームに結合して、その機能を阻害してしまうということが分かりました。
したがって、変性プリオンがあるとプリオン以外の変性タンパクについてもプロテオソームで分解されにくくなります。
そのため,細胞内ではますます変性したタンパクが蓄積され、やがて変歩行困難などを引き起こします。これがプリオン病の発症メカニズムです。潜伏期間は長く,短くても8年から10年と考えられています。また,発症後の致死率は100%で,発症後1年程度で死亡することになります。また変性プリオンタンパクは熱に対しても抵抗性が強く、通常の加熱処理ではその活性を失わせることが困難であり、失活させるには134℃で18分間加熱する必要があります。
11. 牛のプリオン病,狂牛病(BSE)について

次に牛海綿状脳症、いわゆる狂牛病について簡単に解説をしていこうと思います。
狂牛病は,1986年にイギリスで初めて報告された牛の病気です。この病気を発症した牛では,脳組織が海綿状(スポンジ状)であることから,正式には牛海綿状脳症と名付けられました。
英語では,Bovine Spongiform Encephalopathy「Bovine=牛」「Spongiform=海綿状」「Encephalopathy=脳疾患」の略称でBSEと呼ばれます。
この写真のように、狂牛病を発症した牛は神経系の異常が起きており、正常に歩くことができません。
狂牛病は,1980年の後半から1990年の初期にイギリスの農場から流行が始まり、やがて全ヨーロッパに広がり,更に北アメリカでも発症が確認されました。2001年に,日本でも発症した牛が確認されました。流行のピークは1992年で,この年には世界で3万7000頭もの牛が感染したことがわかっています。1996年4月末から2001年末までの期間に、世界中で約530万頭の牛が殺処分されました。
12. 狂牛病が世界中に流行した原因:肉骨粉
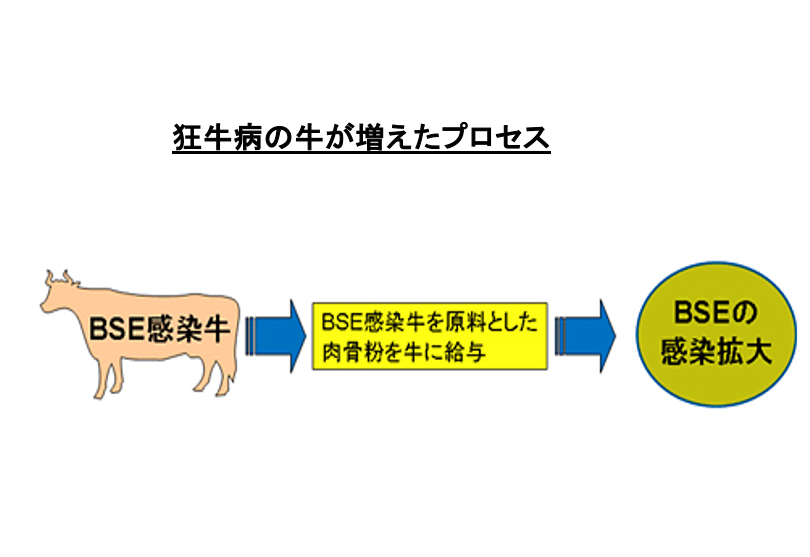
このように狂牛病が急速に増えたプロセスについて解説をします。
どの国でも病気に感染した牛の肉は食用には使うことができません。そのため,狂牛病の牛は,肉骨粉として牛の飼料の原材料として使われるということになりました。 狂牛病の牛の肉骨粉を正常な牛が食べることによって,変成プリオンタンパクが正常な牛に取り込まれて,先ほどのメカニズムに従って,正常な牛でも変性プリオンの蓄積が開始することになります。
厄介なことに,変性プリオンタンパクは胃においても消化されにくいこと,また,加熱しても変性プリオンタンパクとしての性質がなくならない事が,狂牛病由来の肉骨粉により,この病気を広がる原因となりました。経口摂取された変性プリオンタンパクが,消化されないまま腸管のリンパ装置から侵入し、近接した神経繊維を経て脳に侵入するものと推測されています。
13. 狂牛病のヒトへの感染
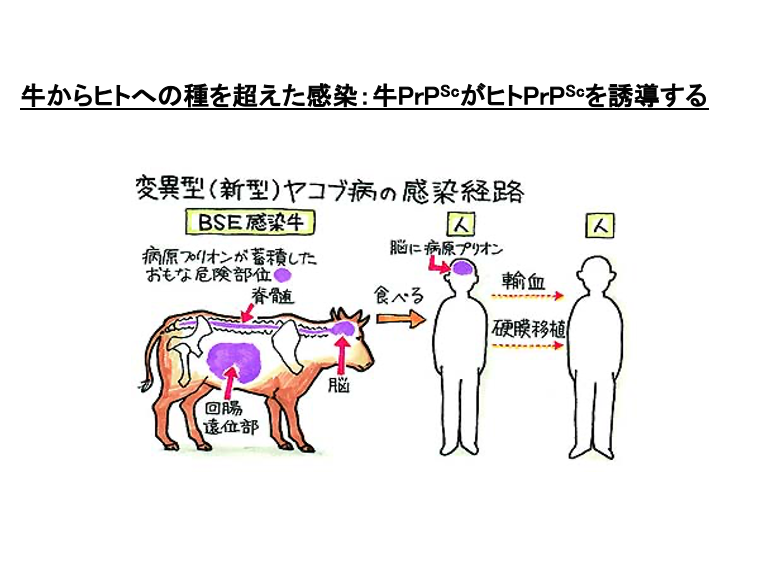
狂牛病の牛がたくさん増えるということだけでも問題なのですが, さらに深刻な事態に発展したのは,牛から人へ狂牛病が感染することが分かったからです。狂牛病に感染した牛の肉,特にプリオンタンパクの蓄積が顕著な脊髄や脳付近の肉を摂取しますと 変成した牛のプリオンタンパクがヒトの体内に取り組まれ 正常なヒトのプリオンを変性プリオンに変えてしまうということが分かりました。牛からヒトへの種間感染が起こるということが見つかり,問題が深刻化しました。
14. プリオン病の終息と自然発生率

これらの新聞記事は,2001年当時日本において国内で初めて狂牛病に感染した牛が発見された時の新聞です。 このように,世界中を震撼させた狂牛病ですが病気に感染した牛を肉骨粉の原材料として使わないというルールが確立されて, やがて世界中で狂牛病の発症は収束しました。
クロイツフェルト・ヤコブ病(Creutzfeldt‐Jakob disease, CJD)の自然発生率は100万人に一人の割合とされています。自然発症したクロイツフェルト・ヤコブ病の患者由来の角膜移植を受けたような場合は,その正常人もクロイツフェルト・ヤコブ病を発症する可能性があります。残念ながら,その治療法は見つかっておれず,現在においても不治の病です。変性プリオンタンパクのみに結合する抗体の生産を促すワクチン治療などの開発が期待されています。
15. 酵母にもあるプリオンタンパク様のタンパク
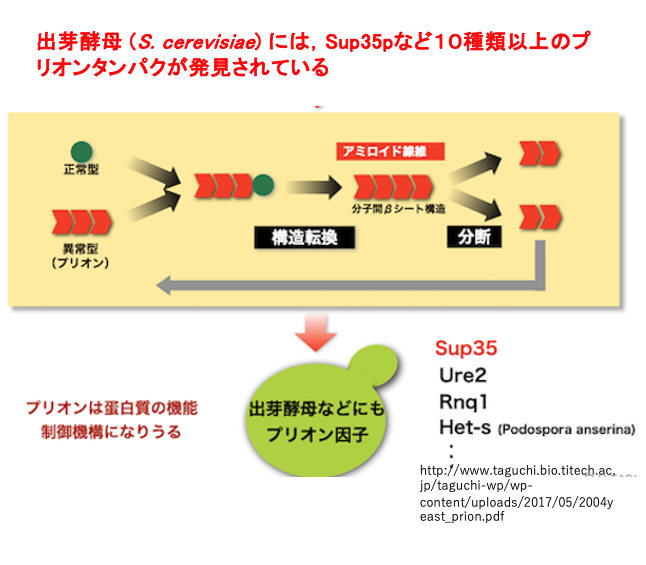
最近においては,プリオンタンパクはもう少し広い意味で捉えられるようになっています。正常なタンパクに作用して,その立体構造を変性させて,別の安定な立体構造にしてしまうような,触媒作用を持つタンパクを 広くプリオンタンパクというふうに捉えられています。
このような意味においるプリオンというのは,人や牛のプリオン病の原因であるプリオンタンパクと 相同性を持つ必要性がありません。 このような広い意味でプリオンを定義しますと,酵母のSaccharomyces cerevisiaeには SARP35など10種類以上のプリオンタンパクが存在します。酵母の中には,正常なタンパクに働きかけて その立体構造を自分と同じ異常系に変換させて細胞内に蓄積する, そのような振舞いをするタンパクが少なくても 10種類は見つかっているということになります。
しかも,酵母の場合、変性タンパクの蓄積が 必ずしも細胞にとって不都合なものでないようです。 原則として,あるタンパクの立体構造は,他の立体構造と比べて圧倒的に安定な一つの立体構造しかない。この事は生体が秩序だった代謝系を安定に維持するために必須です。しかし,酵母の生育環境においては,むしろこのような変性したタンパクが蓄積する方が生存にとって好都合であるというふうな環境も知られるようになってきました。このような,タンパクはもっと高等な生物においても見つかるかもしれません。
コメント