この講義の内容は下記のYouTubeサイト(再生リスト:生命科学を専攻する学生の為の分子生物学講義)で動画として視聴できます
https://youtu.be/V8wOmw-LicA
1. この講義は以下の内容について解説をしています
1. 動物細胞ゲノムにある5mCpGのメチル化の特徴
2. ヒトのゲノムにおけるCのメチル化頻度
3. ゲノムにおけるCpG配列の忌避
4. 真核生物におけるメチル化シトシンによる転写抑制メカニズム
5. 原核生物におけるDNAのメチル化の種類と役割
6. 5mCpGのメチル化維持メカニズム
7. 動物細胞におけるCpG配列の脱メチル化反応
8. ミスマッチ塩基対の塩基除去修復
9. スマッチ塩基対の形成と塩基除去修復によるG:C塩基対の再形成
10. ヒトの発生初期における受動的な脱メチル化と能動的な脱メチル化
Keywords: CpG配列, 5-methylcytosin, DNA methyltransferase, S-adenosyl methionine, SAM, CpGアイランド, 制限修飾系 (R-M系), 維持型メチラーゼ, DNMT1, PAF15, ユビキチン化,脱メチル化,スマッチ塩基対、塩基除去修復,TET酵素、DNAグルコシラーゼ (TDG),発生初期,インプリンティング遺伝子、エピジェネティクス
2. 動物細胞ゲノムにある5mCpGのメチル化の特徴
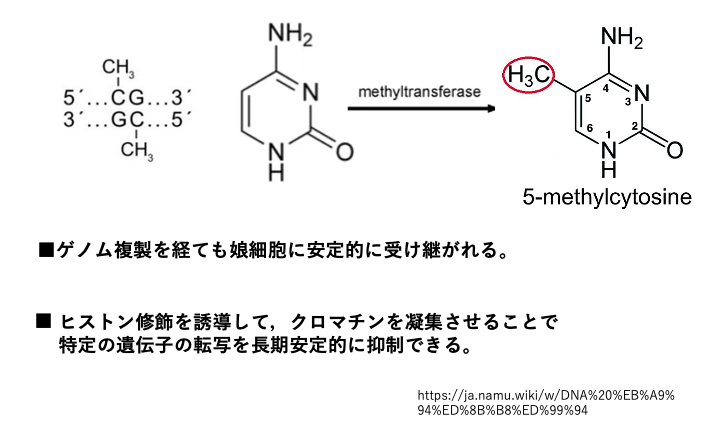
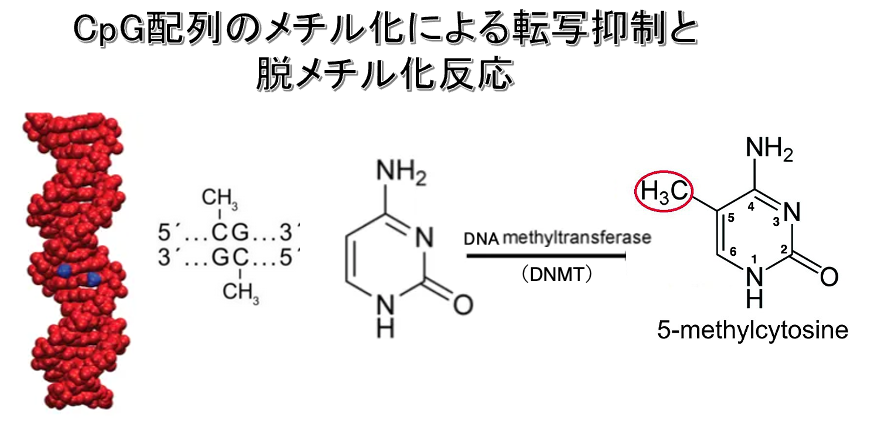
動物細胞のゲノムで見られる塩基修飾のほとんどは,CpG配列内のシトシンの5位の炭素のメチル化です。
5-methylcytosineではシトシン塩基の5位の炭素の水素がメチル基に置換しています。この反応を行うのが DNA methyltransferaseです。
2本鎖DNAにおいてCpG配列は点対象な配列です。一方の鎖においてCpG配列にメチル化修飾がある場合,相補鎖上の対象な位置にあるCpGにもメチル化修飾が見られます。
メチル化されたCpG配列は,ゲノム複製後のDNA鎖でも受け継がれています。また,メチル化されたCpG配列はヒストン修飾を誘導して,クロマチンを凝集させることで特定の遺伝子の転写を長期安定的に抑制できます。
3. メチル基転移反応:DNMT酵素とメチル基供与体SAM
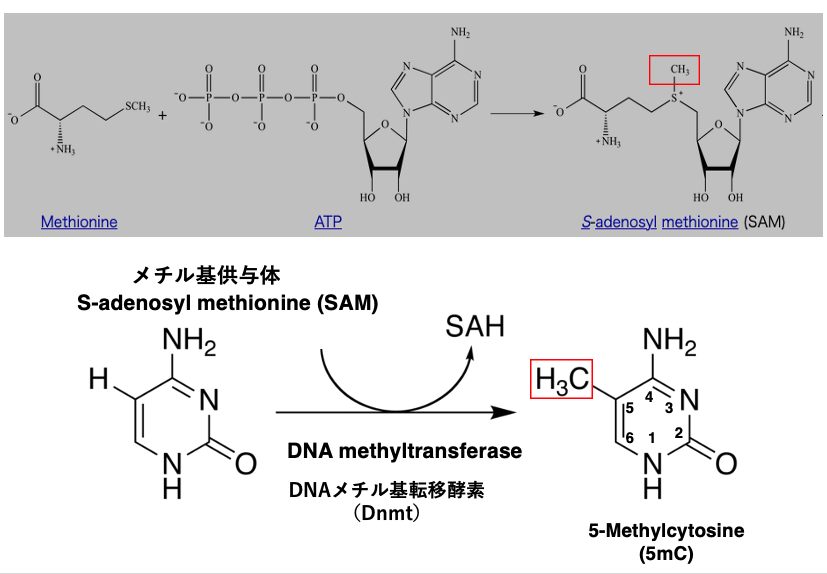
シトシンのメチル化を触媒する酵素はDNA methyltransferaseで,DNMTと表記されます。
転移に用いられるメチル基の供与体はS-adenosyl methionineです。S-adenosyl methionineは,この図にあるようにアミノ酸のMethionineとATPの複合体です。
4.ヒトのゲノムにおけるCのメチル化頻度
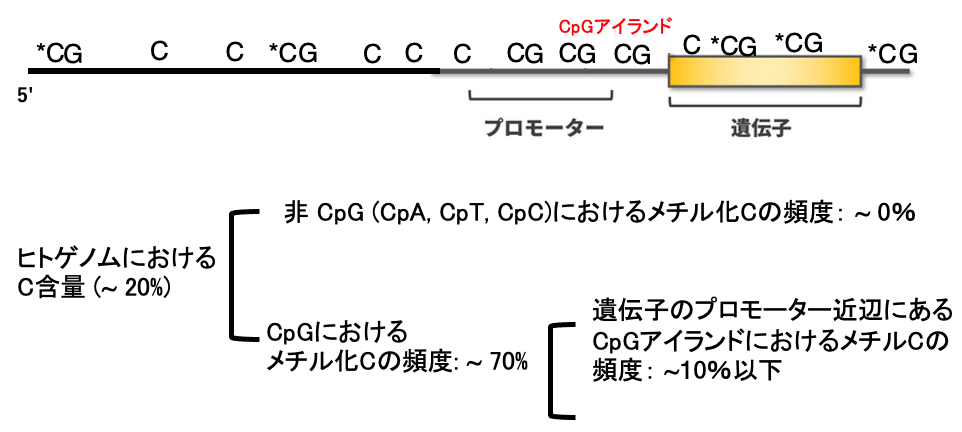
ヒトゲノムにおけるシトシン含量はおよそ20%です。CpA, CpT, CpC配列内のシトシンのメチル化配列は,ほぼゼロです。一方,CpG配列内のシトシンのメチル化配列はおよそ70%です。ただし,ゲノム内のどこに位置するCpG配列なのかによって,そのメチル化率は大きく異なります。
遺伝子のプロモーター近辺,500 bp-3,000 bp領域には,その他の部域よりもCpG配列が多くみられるので,CpGアイランドと呼ばれます。このCpGアイランドに限り,シトシンのメチル化頻度は低く,10%程度しかありません。
5. ゲノム内位置の違いによるCpGアイランドのメチル化頻度比較
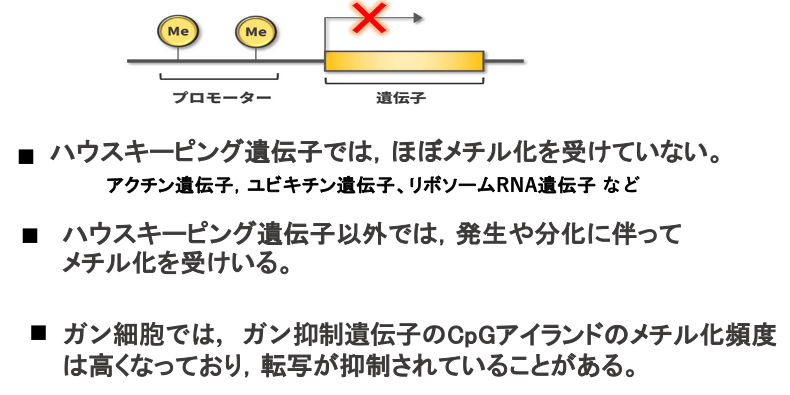
CpGアイランドでは,一般的にはシトシンのメチル化頻度は低いですが,それでもバラツキが観察されます。
細胞の基本的な機能維持に関与している遺伝子はハウスキーピング遺伝子と呼ばれます。アクチン遺伝子,ユビキチン遺伝子、リボソームRNA遺伝子などがその例です。
これら常に転写量が多いハウスキーピング遺伝子では,そのCpGアイランドのメチル化率は,ほぼゼロです。一方で,ハウスキーピング遺伝子以外では,発生や分化に伴ってメチル化を受けています。また,ガン細胞では,ガン抑制遺伝子のCpGアイランドのメチル化頻度は高くなっており,転写が抑制されていることがあります。
6. ゲノムにおけるCpG配列の忌避
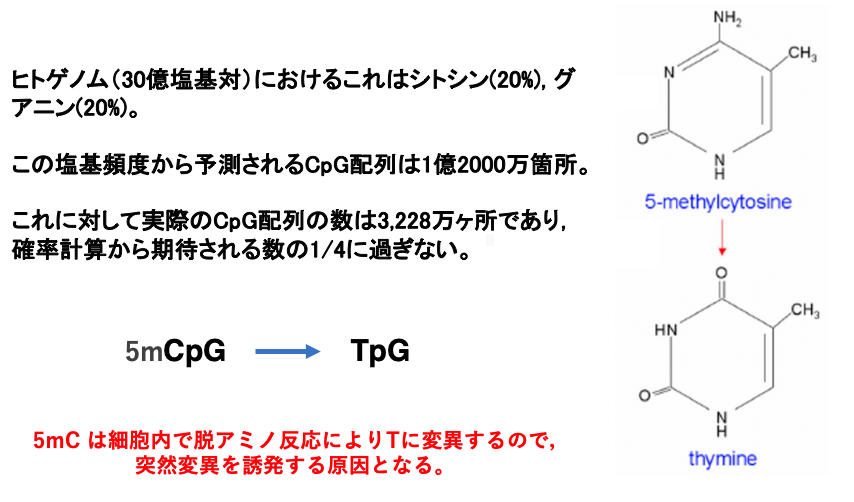
CpG配列は,ゲノムにおけるシトシンの存在比率から算出される出現率よりも大きく下回っていることが分かっています。
ヒトのゲノムは凡そ30億塩基対で構成されています。シトシンとグアニンの出現比率はいずれも20%なので,ゲノム内のCpG配列の数は1億2000万箇所と推定されます。これに対して実際のCpG配列は3,228万ヶ所であり,確率計算から期待される数の1/4に過ぎません。
この事から,ヒトゲノムではCpG配列を積極的に避けられるような進化圧が作用していると思われます。そのような進化圧として,5mCは細胞内で脱メチル化が起きやすく,それにより塩基がチミンに変化してしまうことが考えられます。このチミンがゲノム複製前に除去されないと,突然変異の原因になります。
7. 陸上植物のDNAメチル化パターン
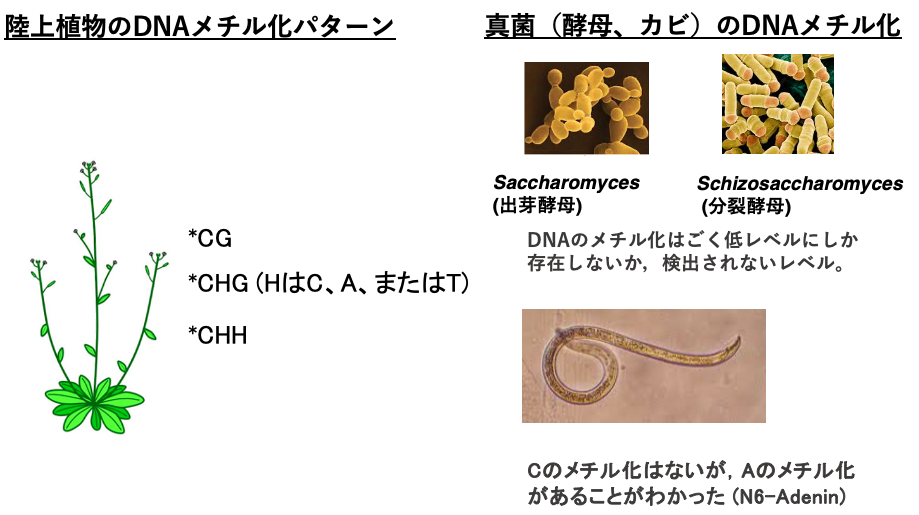
ヒト以外の真核生物における塩基修飾を見てみましょう。
植物では,CpG配列の他に,CHGやCHH配列内のシトシンが,動物と同じように5mCに修飾されている場合があります。
一方,酵母やカビなどの真菌類では塩基の修飾はほとんど検出されないくらい低いです。また,線虫ではシトシンのメチル化修飾はありませんが,アデニンがメチル化を受けています。
8. 真核生物におけるメチル化シトシンによる転写抑制 (1)
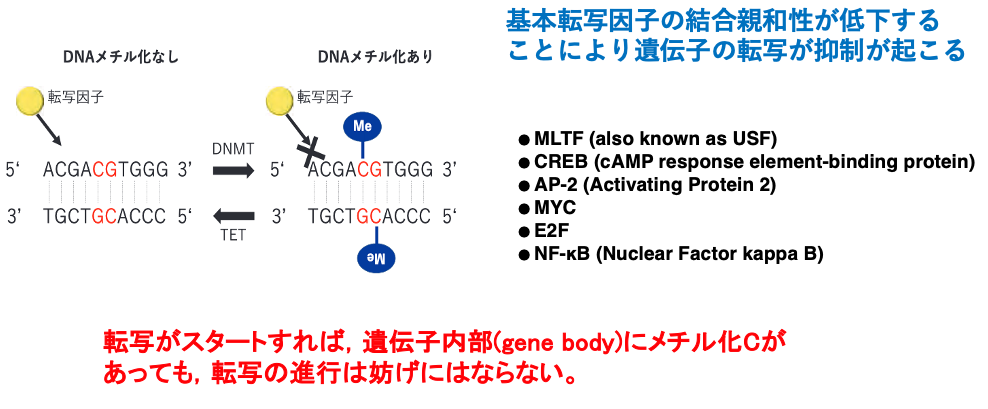
メチル化Cの転写に与える影響について解説をしていきます。
プロモーター配列中のシトシンがメチル化されることで,ここに示したような転写因子のプロモーターへの結合親和性が低下します。これにより,転写頻度が抑制されることになります。
一方,転写がスタートすれば遺伝子内部 (gene body) にメチル化Cがあっても,転写の進行は妨げにはなりません。
9. 真核生物におけるメチル化シトシンによる転写抑制 (2)
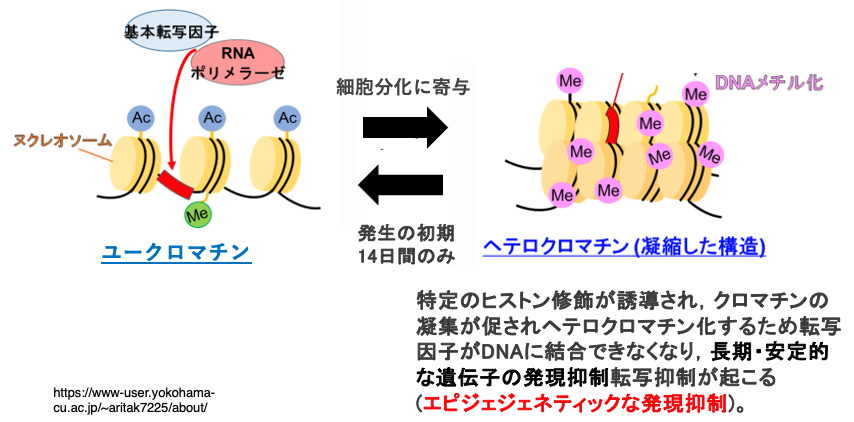
またシトシンのメチル化は,特定のヒストン修飾を誘導します。ヒストン修飾によりクロマチンの凝集が促され,ヘテロクロマチン化するため転写因子がDNAに結合できなくなり,長期・安定的な遺伝子の発現抑制転写抑制が起こります。
このようなDNA修飾とヒストン修飾が共役して形成される安定で強固な遺伝子発現の抑制をエピジェネチックな発現抑制と言います。塩基配列に突然変異が生じている訳ではないのに,まるで遺伝子に突然変異が起きたような振る舞いをするというのが“エピジェネチック”の意味です。
10. 原核生物におけるDNAのメチル化の種類
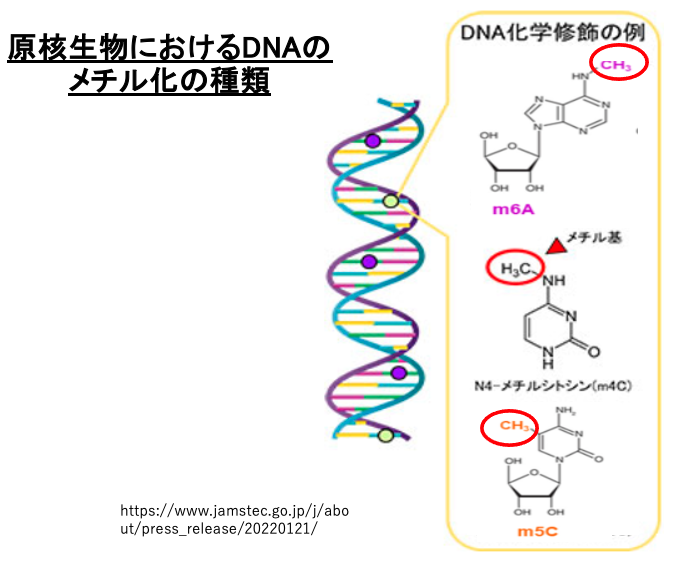
原核生物のゲノムにも修飾塩基が見られます。修飾塩基としては,アデニンのメチル化やシトシンのメチル化があります。
11. 細菌におけるDNAメチル化酵素の分類
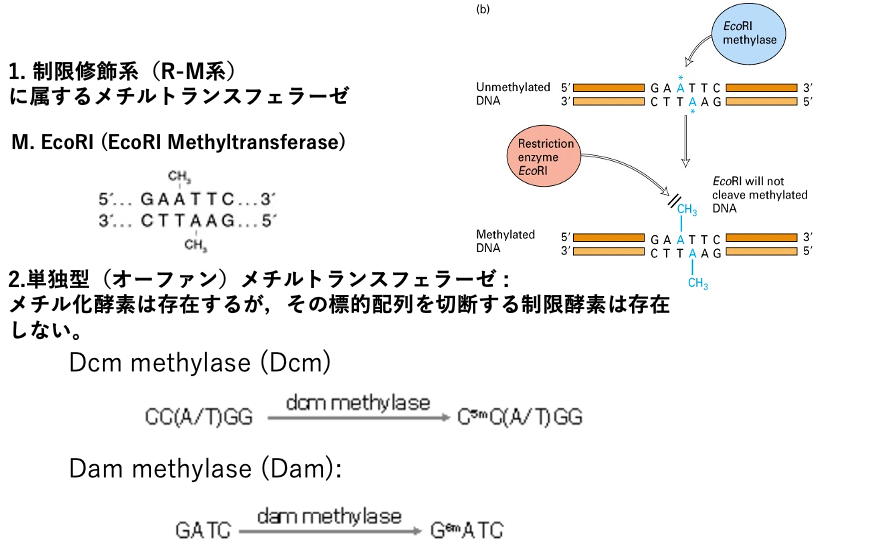
細菌が持つDNAメチル化酵素は,その機能から2系統に分別されます。
細菌はファージなどの寄生的な因子の侵入と増殖を防ぐために,制限酵素を自身の細胞内部に持っています。一方で制限酵素により,自己のゲノムが切断を防ぐために標的配列内のシトシンやアデニンをメチル化するDNAメチル化酵素を持っています。このシステムは制限修飾系 (R-M系) と呼ばれます。
例えば,EcoRI methyltransferaseは5′-GAATTC-3’配列のアデニンをメチル化することにより,Restriction enzymeのEcoRIにより,ゲノム内にこの配列があっても切断されないようにしています。
もう一つは,修飾制限系に属さないメチル化酵素で,単独型とかオーファン型と呼ばれます。よく知られているものにDcm methyltransferaseやDam methyltransferaseがあります。それぞれの標的配列を切断するような制限酵素はありませんが,特定の配列内のシトシンやアデニンにメチル化修飾を導入します。
12. 原核生物におけるDNAのメチル化が担う機能
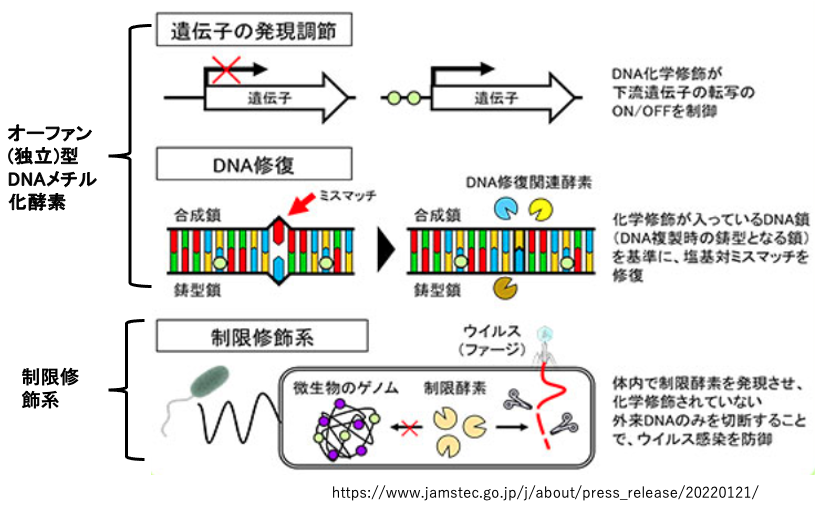
オーファン(独立)型のDNAメチル化の役割としては,遺伝子発現量の調整やミスマッチ塩基の修復において,古い鎖と新生鎖を識別するシグナルとしての役割があります。
13. CpG配列内の5mCの維持機構(娘細胞への伝達)
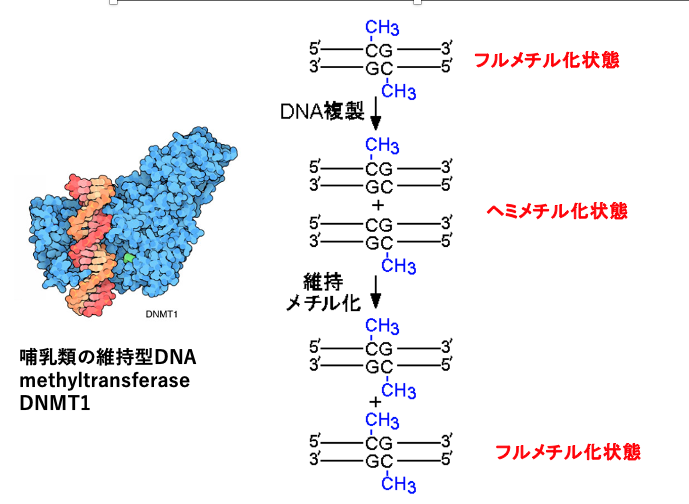
CpG配列内のメチル化シトシンがDNA複製後も維持される機構について説明をします。
DNAの複製が始まる前には,両鎖のCpG配列がメチル化されており,この状態をフルメチル化状態といいます。DNA鎖の複製が行われると,古い鎖のCpGのメチル化は残されたままですが新たに合成された鎖のCpGにはメチル化がありません。この状態はヘミメチル化と呼ばれます。
新生鎖のメチル化されていないCpGサイトにメチル化修飾を行うDNA methyl transferaseがあり,哺乳類ではDNMT1と命名されています。DNMT1は,DNA複製前にあったCpGメチル化サイトにメチル化を導入する酵素なので,維持型メチラーゼと呼ばれます。
このような維持型メチラーゼの他に,これまでにメチル化されていないシトシンにメチル化修飾を導入するメチラーゼもあり,こちらはde novo methyltransferase (de novo : 新たに)と呼ばれます。DNAの新たなサイトへのメチル化導入のメカニズムに関しては,この講義には含まれていません。
14. S期後期におけるヘテロクロマチン領域の*CpG/CpGのフルメチル化機構
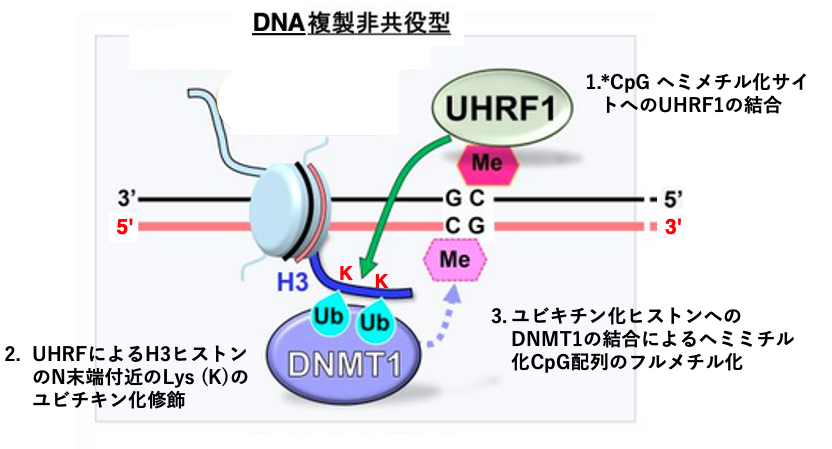
維持型メチラーゼのDNMT1がヘミメチル化サイトをどのように,フルメチル化するのかを解説します。このフルメチル化にはDNA合成のS期前期とS期後期で少しメカニズムに違いがあります。
まずは,S期後期におけるDNA複製と共役しない (同時に起こらない) 複製非共役型のフルメチル化について解説します。DNMT1メチラーゼはヘミメチル化サイトを認識してDNAをメチルト化するのであれば,単純で分かり易いのですが,そうではありません。
ヘミメチル化CpGサイトに結合するタンパクとしてUHRF1があります。UHRF1はヘミメチル化CpGサイトに結合すると,その近傍にあるH3ヒストンのN-末端付近のLys (K)にユビキチン修飾を行います。H3ヒストンのN-末端がユビキチン修飾されることで,DNMT1メチラーゼが呼び込まれて,未修飾のCpGをメチル化します。
15. S期前期におけるユークロマチン領域の*CpG/CpGのフルメチル化機構
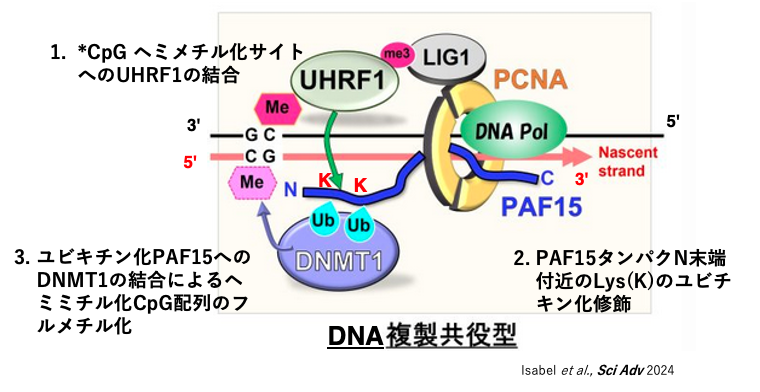
次にS期前期における,DNA複製に共役した新生DNA鎖のメチル化について説明します。
この場合,ヘミメチル化サイトに付着したUHRF1はH3ヒストンではなく,DNA複製複合体に含まれるPAF15タンパクのN-末端のLysをユビキチン化します。
それによりメチル化維持酵素であるDNMT1がPAF15タンパクに呼び込まれ,未修飾のCpGをメチル化します。これがS期前期でみられるDNA複製共役型のCpGメチル化維持の機構です。
16. 動物細胞におけるCpG配列の脱メチル化反応
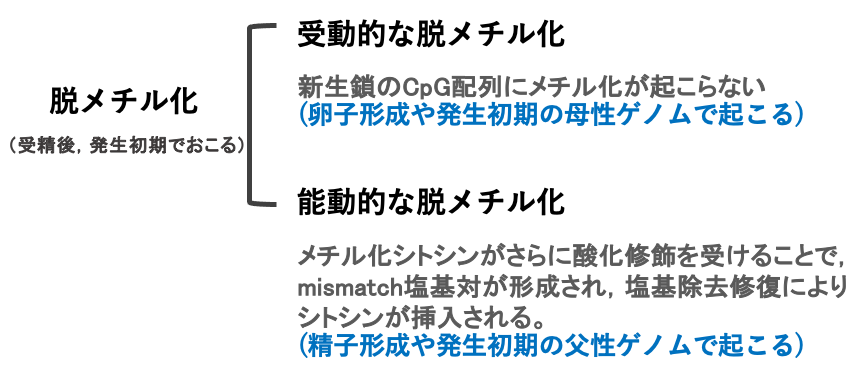
これまではメチル化CpGの機能と維持機構について解説してきましたが,ここでメチル化CpGの脱メチル化の機構についても解説します。
メチル化CpGの脱メチル化には,2つのメカニズムがあります。受動的な脱メチル化と能動的な脱メチル化です。
受動的な脱メチル化は,DNMT1酵素が働かないために新生鎖のCpG配列にメチル化修飾が起こらないことで起こります。DNMT1酵素が働かないと,DNA複製の度に非メチル化CpGサイトが増加することになります。これは,発生初期の母親由来のゲノムについて起こります。
一方で,能動的な脱メチル化は5mCがさらに酸化修飾を受けることで,積極的にミスマッチ塩基対が形成され,塩基除去修復により修飾を受けたシトシン塩基が切り取られ,その後にシトシンが挿入されることで実現します。動物細胞では,精子形成時や発生初期の父性ゲノムについて,この能動的なシトシンの脱メチル化が起こります。
17. ウシの体細胞と精子におけるCpGメチル化頻度の比較
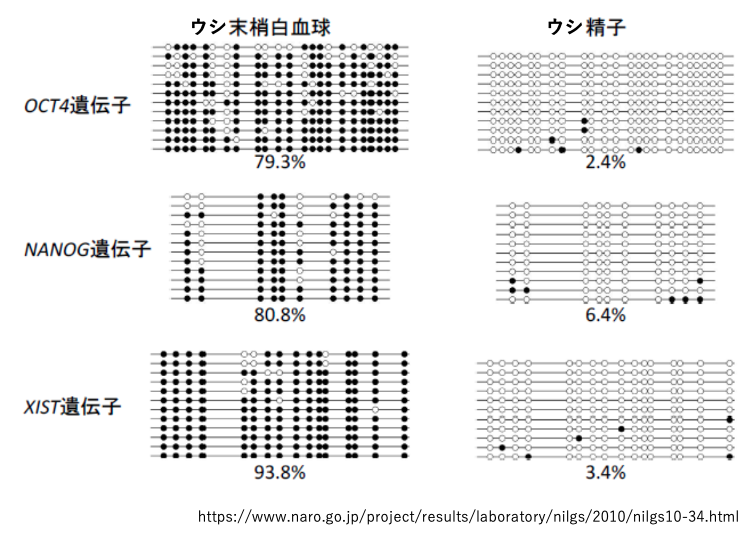
これはウシの体細胞の一種である白血球と生殖細胞である精子について,OCT4遺伝子,NANOG遺伝子,XIST遺伝子についてCpG配列のメチル化について解析したデータです。黒丸はメチル化されたCpGサイト,白丸は非メチル化CpGサイトを示しています。
白血球において,これらの遺伝子のCpGサイトの多くはメチル化されていることが分かります。一方で,精子ではほとんどのCpGサイトはメチル化されていないことがわかります。つまり,ウシでは精子形成の過程で大規模なメチル化CpGの脱メチル化が起こっていることが分かります。
18. ミスマッチ塩基対の塩基除去修復
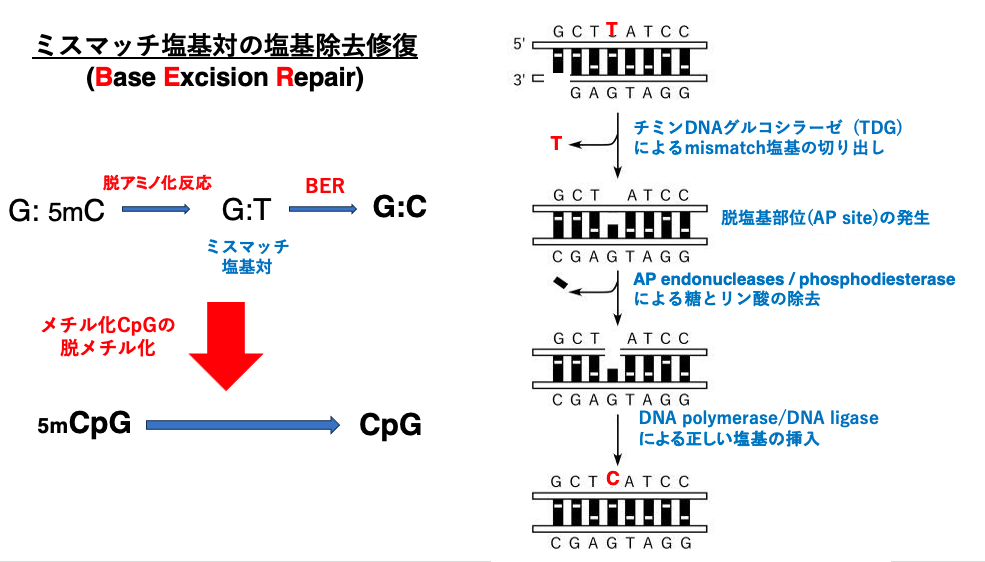
能動的なCpGの脱メチル化はミスマッチ塩基対の塩基除去修復によっておこるので,まずミスマッチ塩基対の塩基除去修復について説明します。
5mCは細胞内で脱メチル化反応を受けやすく,この反応により5mCはチミンに変換されます。そのためG:5mCの塩基対合だったサイトはGとTのミスマッチ塩基対になります。
このミスマッチ塩基対はチミン塩基がチミンDNAグルコシラーゼ (TDG) によって切り出され,脱塩基部位 (AP Site) が発生します。
AP endonucleasesとPhosphodiesteraseによってリン酸基と糖が切り出された後,DNA polymerase/DNA ligaseによって,Deoxycytidine monophosphate (dCMP、修飾のないシトシン) が挿入されます。その結果として,メチル化CpGは非メチル化CpGに脱メチル化されたことになります。
19. TET酵素によるミスマッチ塩基対の形成と塩基除去修復によるG:C塩基対の再形成
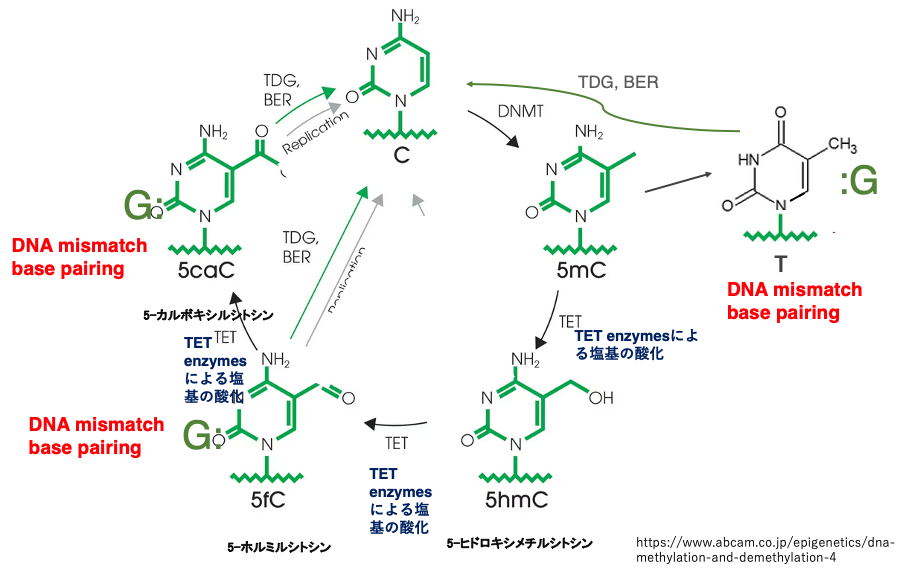
この図はシトシン塩基の様々なメチル化修飾とミスマッチ塩基対の形成についてまとめたものです。
シトシンは維持型メチル化酵素DNMT1によって5mCに変化します。この時,Gと5mCの塩基対合はミスマッチ対合だとは見なされないので,5mCの切り出しは起こりません。
能動的な脱メチル化が機構が活性化した場合,5mCはTET酵素によって5-ヒドロキシメチルシトシン (5hmC)、さらに5-ホルミルシトシン (5fC)に変化します。Gと5fCの対合はミスマッチ塩基対と判断され,5fCはチミンDNAグルコシラーゼ (TDG)によって切り出されます。
その後,塩基除去修復によってdCMPが挿入されることでG:C塩基対合となります。
また,5fCが切り出されない場合は,TET酵素によりさらに5fCがさらに酸化されて5-カルボキシルシトシン (5caC) に変化し,ミスマッチ対合と判断されることで,塩基除去修復により非メチル化Cが挿入されます。
このように,5mCがTET酵素によって酸化されることで,ミスマッチ塩基対を作り出し,塩基除去修復システムにより除去されることで,メチル化Cは修飾のないシトシンへと脱メチル化します。
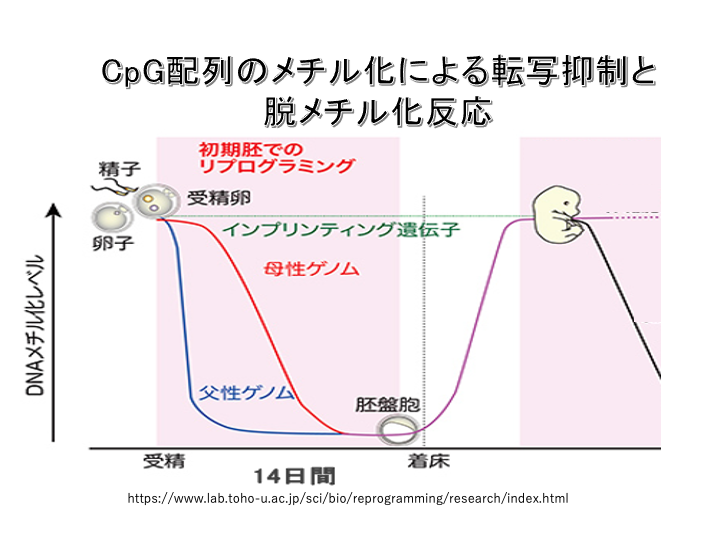
20. ヒトの発生初期における受動的な脱メチル化と能動的な脱メチル化
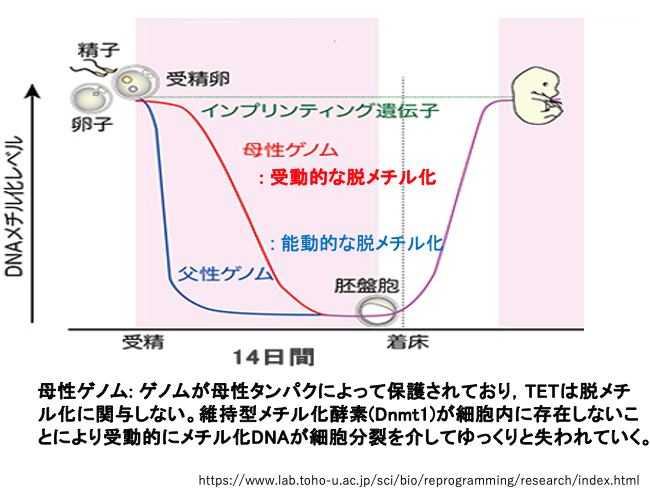
この図はヒトの発生初期におけるDNAメチル化頻度の変化を示しています。
ウシの場合と異なりヒトでは生殖細胞形成期には,まだ脱メチル化は起きていません。受精後の発生初期14日間に大規模な脱メチル化が起こります。
卵由来の母性ゲノムは母性タンパクによって保護されているためTET酵素は作用しません。また受精卵の内部にはDNMT1酵素が無いために,細胞分裂を通してゆっくりとした受動的なメチル化シトシン頻度の低下が起こります。
一方,精子由来のゲノムではメチル化シトシンがTET酵素により酸化され,ミスマッチ塩基対が形成されることで除去され,急速にメチル化シトシンの頻度が低下します。
この発生初期においてもメチル化シトシンの脱メチル化が起きない100 – 200個の遺伝子があり,インプリンティング遺伝子と呼ばれます。
コメント