この講義の内容は下記のYouTubeサイト(生命科学を専攻する学生の為の分子生物学講義)で視聴可能です
https://www.youtube.com/watch?v=bNlnNJ4uUQw&t=27s
1. この講義には下記のような内容が含まれています 。20枚の図が含まれています。
- タンパクの1次構造:αヘリックス,βシート
2.アンフィンセンのドグマ Anfinsen’s dogma
3.αヘリックス: 右巻きらせん,3.6アミノ酸で1回転
4.βシート:逆平行βシート(antiparallel)、平行βシート (parallel)
5.タンパクの3次構造:アミノ酸の側鎖の性質による立体構造の構築
6.側鎖間に働く力:水素結合,イオン結合,疎水性相互作用,ジスルフィド結合
7.ターン構造:βturn,ランダムコイル,天然変性領域
8.タンパク質の四次構造:サブユニットの複合体
9.シャペロンの手助けによる折畳み
10.ヒートショックとHspタンパク:Hsp70, Hsp60
11.新生されつつあるタンパクを折り畳むTrigger Factor 12.シャペロニン複合体による折畳み:GroEL/GroES
Key Words: αヘリックス,βシート, アンフィンセンのドグマ, Anfinsen’s dogma, シャペロン, シャペロニン, 天然変性領域,タンパクの3次構造, GroEL, GroES,Hsp70, Trigger Factor, αhelix, β-sheet, Anfinsen’s dogma, Chaperon, Chaperonin, Natural denatured region, Protein tertiary structure
2. タンパクの一次構造
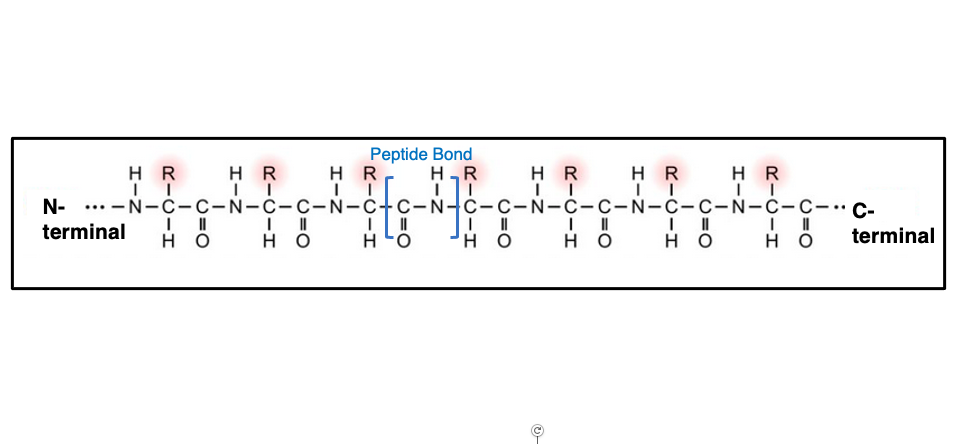
アミノ酸配列のことをタンパクの一次構造と言っています。 ペプチドは各アミノ酸がペプチド結合でつながったポリマーであり,ペプチドにはN末端とC末端があります。 また, 各アミノ酸が持つこのR基を側鎖と言います。
地球上の生物が用いるアミノ酸では,この側鎖は20種類に限定されています。 一つのペプチド鎖が取ることが可能な安定な立体構造は無限にあるように思えるかもしれませんが、 特殊な場合や特別な領域を除けば,ペプチド鎖は特定の一つの立体構造をとります。
タンパクのアミノ酸配列は,特定の一つの立体構造だけが他と比べて圧倒的に自由エネルギーが低くなるように配列となるように進化的な選択を受けてきたというふうに考えることができます。 後でお話しするように、同様に安定な構造が二つあると、それは生物にとって有害であるからです。
3. プリオン病 : 安定な2つの立体構造の存在が引き起こす病気
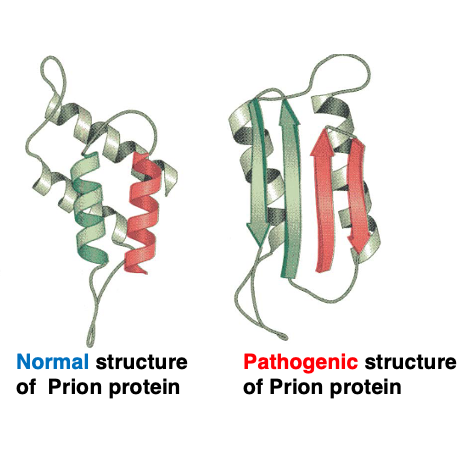
例外的に一つのペプチド酸が同じくらい安定な立体構造をとる例として,プリオンタンパクがあります。 左図は正常な活性を持つプリオンタンパク質の立体構造です。 一方,右図は正常な活性を持たない病原性のプリオンタンパクの立体構造です。
このように二つの立体構造は異なりますが,同じくらいこの二つの立体構造は安定であるということが知られています。このタンパクは,主として神経細胞内で蓄積し,凝集塊を形成します。いわゆるアミロイドですね。人ではこのような正常な立体構造ではないプリオンタンパクが蓄積することで,クロインフェルツトヤコブ病が発症しますし 羊ではスクレイピーと呼ばれる病気、牛ではいわゆる狂牛病、牛海面状脳症が発症します。
このように2つ安定的な立体構造がある場合,一方が正常で他方が正しい活性を示さないわけですけれども,異常なタンパクが蓄積することによって 弊害を引き起こすということになります。正しい立体構造のタンパクも,熱などにより変性して異常な立体構造に変化してしまうことがあります。このようなタンパクも,凝集塊を形成する原因となるので,速やかに分解するためのシステムが細胞内には備わっています。
4. タンパクの立体構造の形成に関するAnfinsen’s Dogma
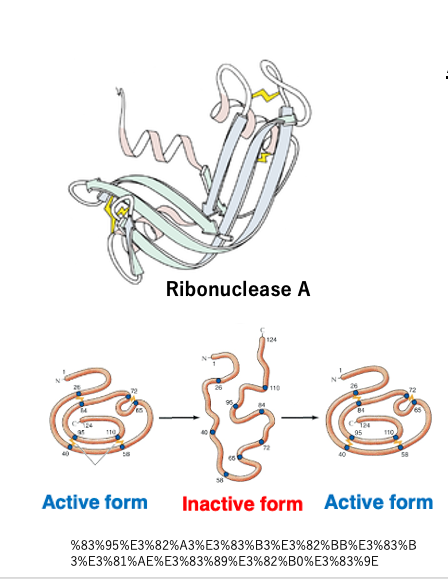
イギリスの研究者であるアンフィンセンは、リボヌークレースA、RNaseを加熱して、その立体構造を壊して不活性型にした後、ゆっくりと熱を取り除くことで、元の活性がある立体構造に戻るということを見つけました。
このような実験結果を基にしてアンフィンセンは、タンパク質の天然構造は、アミノ酸配列さえ決まれば、その立体構造は一義的に決定し、それは熱力学的に最も安定な状態であるという仮説を発表しました。 これをアンフィンセンのドグマと言います。
この仮説は基本的には正しいというふうに考えられています。 タンパク質の立体構造は、そのアミノ酸配列が指定するものであって、その他の情報は基本的には必要がないというふうに考えられています。
5 . ペプチド結合を構成するC, O, N, Hは同一平面上に配置される
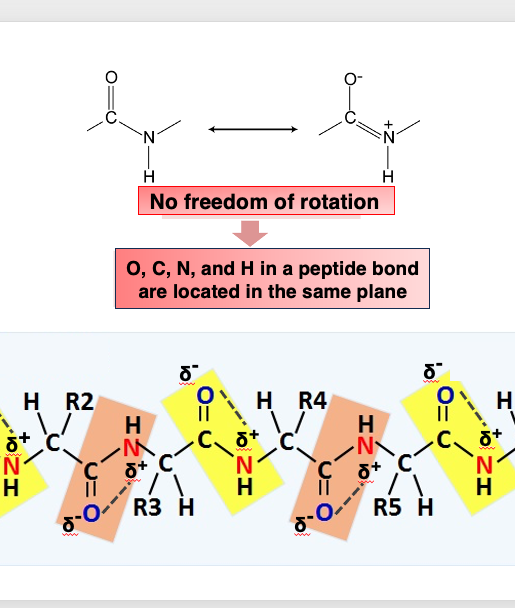
タンパク質において主鎖を構成するペプチド結合ですが、カルボキシル基はδ-に、-NHのNはδ+に帯電して相互に引き合います。 その結果、C, O, N, Hは自由に回転することができません。 そのため,これらの4元素は、同一平面上に配置されることになります。
したがってタンパクの主鎖を見ますと、ペプチド結合は同じ平面上に配置し、一方で,側鎖を形成する元素は自由に回転ができます。
6.α-helix : タンパクの2次構造のひとつ
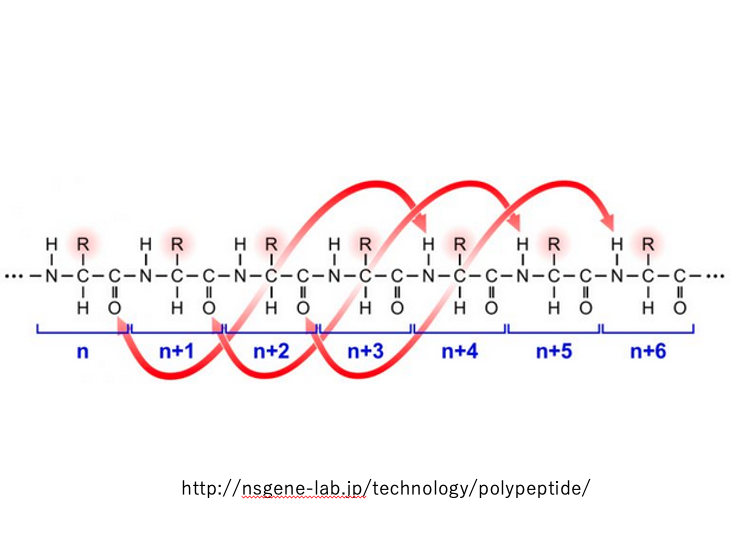
主鎖を構成している n 番目の アミノ酸残基のこれカルボニル基のOが,4アミノ酸残基離れた(n プラス4番目)の アミノ酸残基のーNHとの間で水素結合を形成することで,ペプチド鎖がねじれる力が発生します。
n プラス1番目のこのカルボニル基が n プラス5番目のーNH基との間でと水素結合を作っていくというふうにして,結果的に全ての アミノ酸残基が水素結合に関与します。
その結果,右巻きのらせん構造をとるような立体構造が現れます。 このようなタンパクの2次構造をα-helix構造と言います。
7. α-helix構造:one pitchが0.54nmの右巻きらせん構造
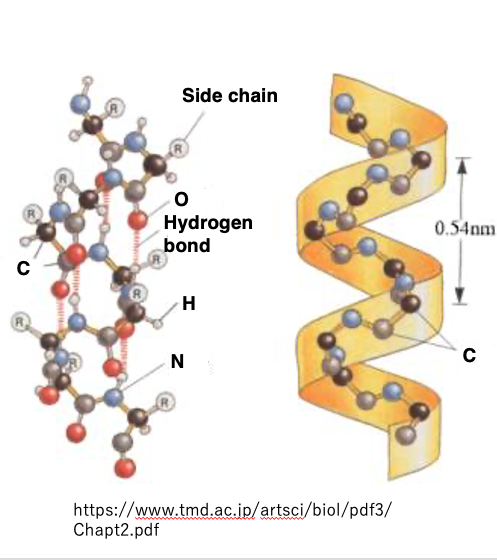
別の図で同じα-helix構造を説明します。 このように,水素結合が規則的に形成されて,側差であるR基はその外側に突き出ているという構造をしています。 one pitchの長さが,0.54nmという右巻き螺旋というのが,α-helix構造です。
8. 右巻きのα-helix構造:one rotation=3.6 a.a.
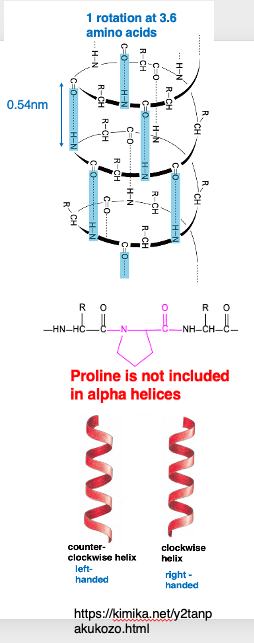
これがα-helixの模式図です。 C=O基 とN-H基の間で水素結合が規則正しく作られています。 n番目のC=O基とnプラス4番目のN-H基の間で水素結合が形成されます。 その結果3.6アミノ酸残基で1回転するような右巻きの螺旋構造が現れます。
このα-helix構造の中には,プロリンが含まれないということがわかっています。 プロリンというのは非常に特殊なアミノ酸で, アミノ基がなく,プロリンを含むペプチド結合では,プロリン残基は,中間図に示してような環状構造を形成しますので,この部分が自由に折れ曲がることはできません。 したがって,ペプチド鎖において,プロリン残基があるような場所では,α-helixはうまく形成されません。逆に言えば,α-helixにはプロリン残基が含まれないという事になります。
右巻き,左巻きについて説明します。右図が右巻き,左側の図が左巻きです。 ねじ釘を思い浮かべて, 時計方向に回転させると前に進むのが右巻きです。 タンパクのα-helix構造の場合は右巻きとなり,左巻き構造は一般的には形成されません。
9. β sheet /β pleated sheet: もう一つのタンパクの2次構造
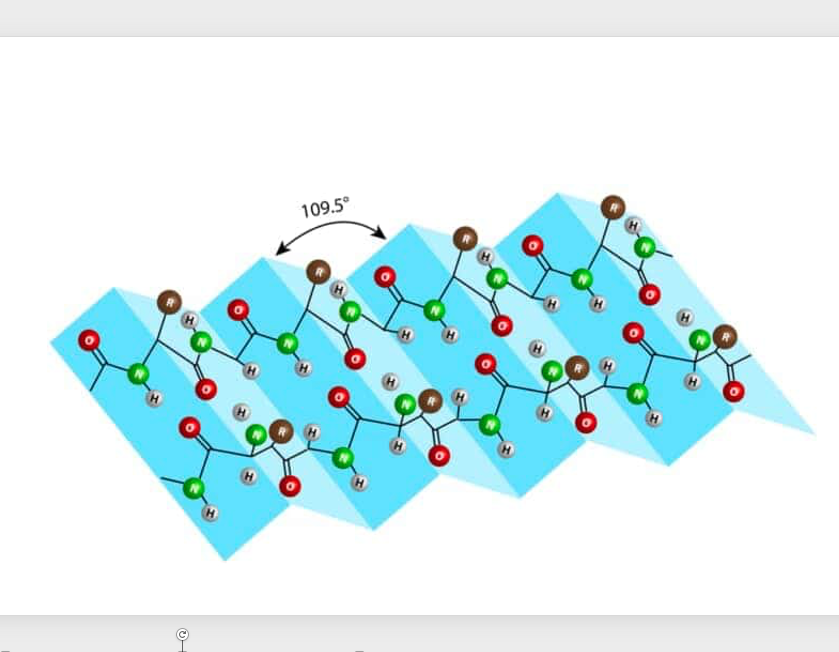
タンパク質の2番目の二次構造としては βプリーツシートあるいはβシートと呼ばれる二次構造があります。
これは長く伸びた2本のペプチド鎖の間で,C=O基 とN-H基の間で水素結合が形成されることにより作られる二次構造のことを言います。
プリーツというのはスカートのひだのことです。 各ひだが109.5度の角度をつけながら 折り重なっているような構造をしています。 これがβプリーツシートあるいはβシートと呼ばれる二次構造です。
10. Parallel β sheetとAntiparallel β sheet
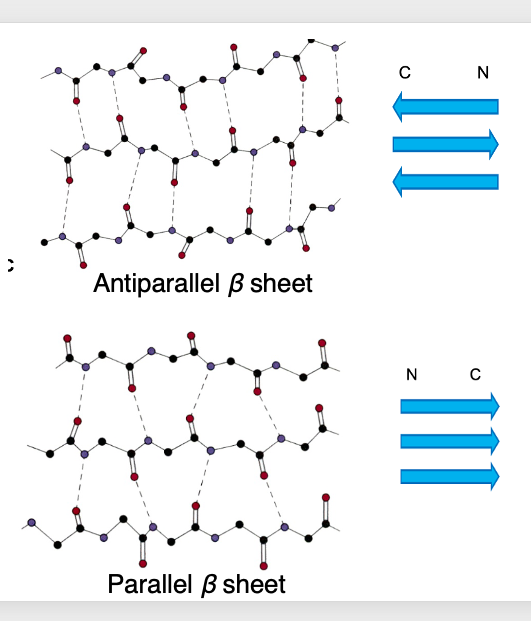
βシートには逆平行βシートと,平行βシートと呼ばれる2通りがあります。
タンパクにはN末端とC末端がありますから 方向性のあるポリマー分子です。 方向性が逆の主鎖の間で水素結合が形成される場合が逆平行βシート,他方,方向性が同じ主鎖のペプチド鎖の間で水素結合が形成される場合が平行βシートが形成されます
11. 逆平行βシート:平面が折れ曲がった構造
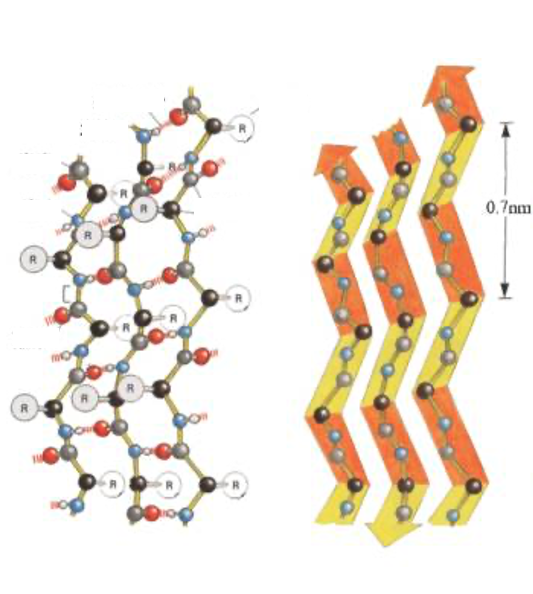
違う図で逆平行βシートを示しています。 方向の異なるペプチド鎖の間で水素結合が形成されていて,このような平面が折れ曲がった構造をしています。
12. Tertiary structure of proteins: α-helice や β-sheetが組み合わされた構造
次にタンパクの三次構造について説明をしていきます。α-heliceやβ-sheetの場合は ,C=O基 とN-H基間の水素結合による立体構造でしたが, タンパクの三次構造を形成するのに強く働くのは各アミノ酸の側鎖です。
各アミノ酸の側鎖の性質が,タンパクがどのように折り畳まれるかを決定する主要な因子になります。つまり疎水性の側鎖を持つアミノ酸を内側に親水性の側鎖を持つアミノ酸残基が外側に配置されるように,ペプチドの折り畳みが起こります。そのため,アミノ酸の一次配列上では遠く離れているアミノ酸であっても,三次構造をとってみると近接するということが起こり得るこりえます。
したがって,正常な立体構造を持つタンパクを抗原として得られた抗体では,熱変性させたタンパクをWestern Hybridization法で検出しようとしても,抗体が認識するエピトープ部位が破壊されているために,検出できない可能性があります。
13. タンパクの3次構造に関与する因子
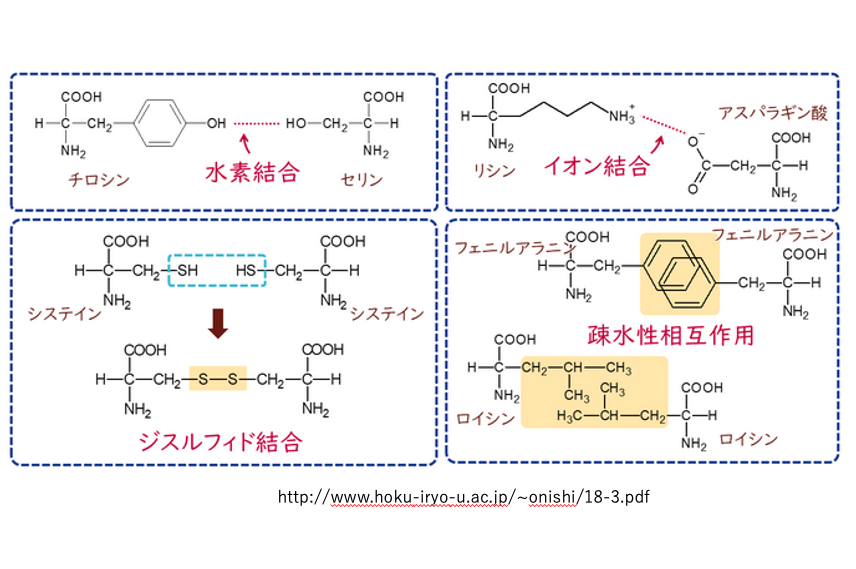
3次構造を決定する側鎖間の相互作用についてここにました。 一つ目は水素結合。2つ目はイオン結合,3つ目が疎水性結合です。4つ目が, SH基の間のS-S結合です。4つの相互作用のなかで,これだけが共有結合です。このような,4つの側鎖間に生じる相互作用が3次構造を決定する主な要素ということになります。
細胞質の中は還元状態にありますので 細胞の中では,システインとシステインの間で S-S結合が形成されることはありません。 しかし,タンパクが細胞外に出ますと,酸化的な環境に晒されることになるので,迅速に S-S結合が形成されて,タンパクは活性を持つ立体構造となります。
14. βturn
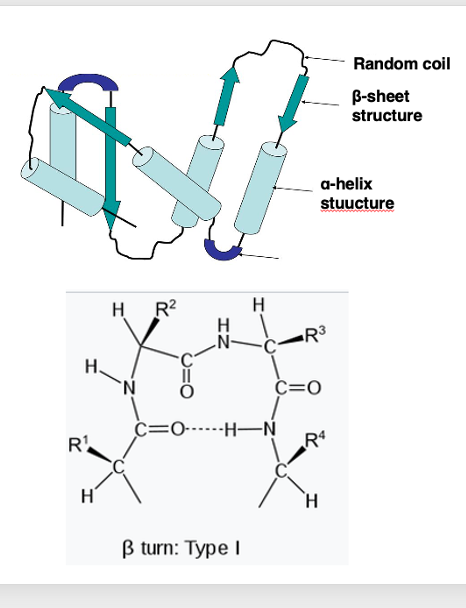
3次構造の他の部分についても,もう少し説明を加えていきます。
αフェリックスとαフェリックスを繋ぐような場所 あるいはαフェリックスとβシートを繋ぐような部分をターン構造と言います。ターン構造の中で最もポピュラーなものが βターンと呼ばれるターン構造です。
βturnの場合は4つのアミノ酸から構成されます。ここに, 4つのアミノ酸残基を示しています。1番目のN-H基と 4番目のC=O基との間で βシート結合が形成されることで,βターン構造が発生します。
またこのようなターン構造を形成するアミノ酸には,プロリンやグリシンが含まれることが多いということが知られています。
15. 天然変性領域: はっきりとした立体構造を持たない部分
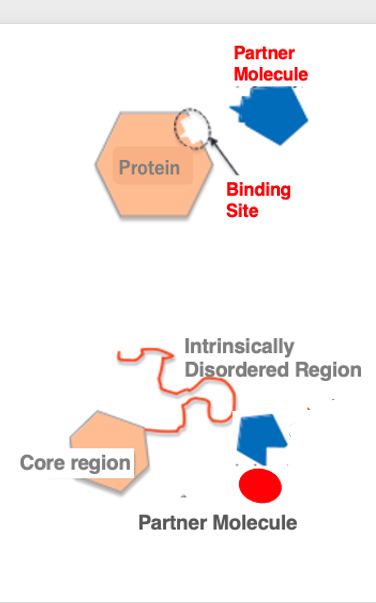
タンパクの中で,はっきりとした立体構造を持たない部分はランダム領域あるいは天然変性領域と呼ばれます。 古くから知られている事として,インタラクションをする2つのタンパクの接触面は,鍵と錠の関係のようにピッタリと収まる凹凸面を持っています。
しかし,最近ではインターラクションをするタンパクであっても,予め鍵と錠の関係に相当するような立体構造を持たない場合があることが分かってきました。 タンパクの立体構造を解析すると,はっきりとした立体構造を持つコア領域の他に,はっきりとした立体構造のない領域があることが分かります。このような領域を,天然変性領域と言います。
この変性領域は,パートナーとなるような分子がそこに付着することによって,初めてリジッドな立体構造が形成される領域であることが,分かってきました。 また,パートナーとなる分子は特定の1種ではなく,細胞内の環境により異なるパートナー分子と複合体を形成します。接触する相手によって,柔軟に立体構造を変化させることができる領域です。
タンパクの中でこのような不規則領域が占める割合は,真核生物では16から22%,原核生物では3から7%です。
16. 4次構造: 3次構造を形成したポリペプチト鎖の集合体
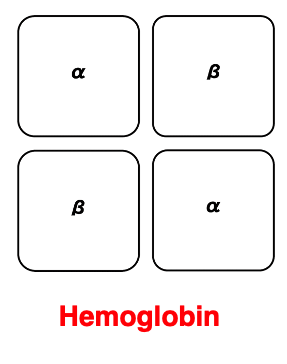
最後にタンパク質の4次構造についても簡単に触れておきます。 3次構造を形成したポリペプチト鎖が 複数会合して特定の機能を効率よくできるようになった ポリペプチト鎖の複合体のことをタンパクの4次構造と言っています。
このような例として, 一番よく知られている4次構造体はヘモグロビンではないかと思います。 ヘモグロビンの場合2つのアルファグロビンタンパクと2つのベータグロビンタンパクで構成されていて, α2β2のヘテロ4両体が生成されることで,酸素を効率よく結合したり放出したりすることができるようになります。
また関連した用語としてコア構造, ホロ構造, あるいはアロステリック構造というふうな関連した事項があるかと思います。これらについては,自分で調べてみてください。タンパク質に関する立体構造の説明は以上です。
17. タンパクの折り畳みを介助するシャペロン分子
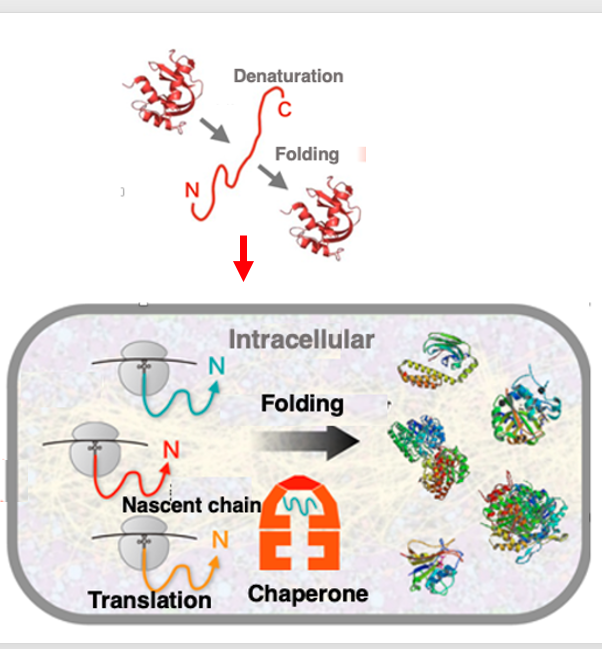
Anfinsenは、RNase Aが熱により変性された後、試験管内で外部からの手助けなしに元の活性のある立体構造に戻ると、いうことを示しました。従ってタンパクは外部の手助けなしに、最もその熱エネルギー状態の低い立体構造を自動的に取ることができるというのがAnfinsenのドグマなのですが、細胞質内では少し状況が異なります。
というのは、細胞の室内ではタンパク濃度が300から350mg/mLであり、非常にタンパクが込み合った状態になるからです。そのため,新生タンパクは迅速に正しい立体構造に折り畳まれる必要があります。さもなければ,周囲のタンパクとの予期しないインターラクションにより,凝集してしまう可能性があります。細胞質内で、アミノ酸配列によって決定される最も重要エネルギーの低い3次構造を迅速にとるためには、その折りたたみを助けるシャペロンと呼ばれるタンパクの介助が必須となります。
細胞の中ではリポソームのLarge subunitから、新生ペプチドのN-末端が出てくるやいなや、シャペロンの手助けを借りた立体構造の折りたたみが始まります。そのことによって,新生タンパクは,いろいろなタンパクが高濃度に存在するような中であっても、他のタンパクと凝集塊を作ることなく、正しい立体構造に折りたたまれることができます。
18. Heat shock protein: シャペロン分子の一種
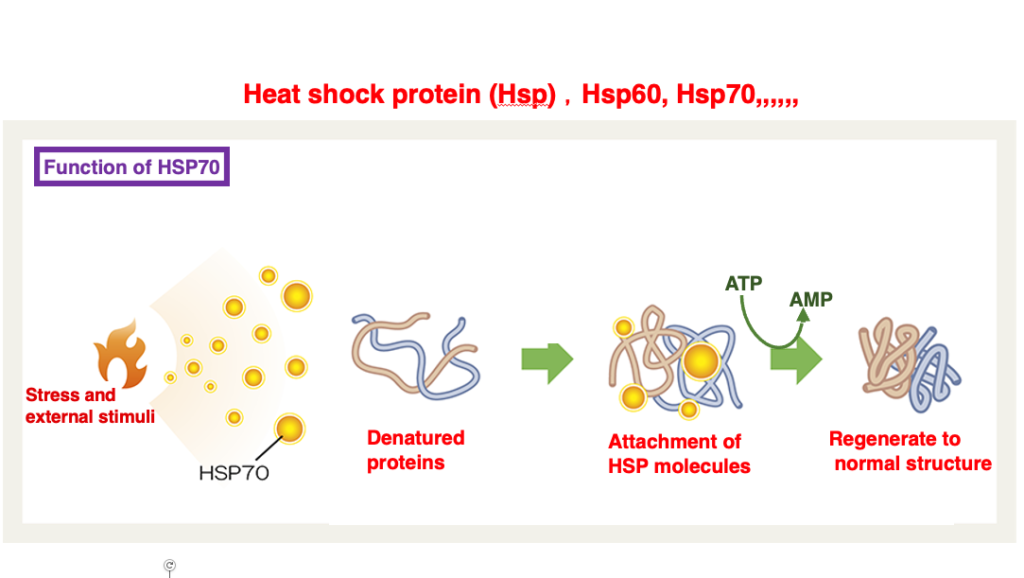
初期に研究されたシャペロン分子として、ヒートショックタンパクがあります。遺伝子記号はHSPが使われることが多いと思います。HSP60,HSP70などのように,タンパクの分子量をダルトンで表した名前が付けられるます。
このタンパクは、大腸菌などの細菌を42℃などの高温にさらした場合に、強く発現される一群のタンパクとして捉えられました。その研究が進むにつれて、これらHSPタンパクは熱ショックによって細胞内で変性したタンパクを元に戻すために使われるタンパクだということがわかりました。
一般にシャペロンタンパクはATPの加水分解を伴いながら,ペプチドが正しく折り畳む手助けをしたり、変性凝集したタンパクを正しい立体構造にたたみ直す手助けをするタンパク分子と、いうふうに今では定義されています。
19. Trigger Factor: 合成されたばかりのタンパクに付着するシャペロン
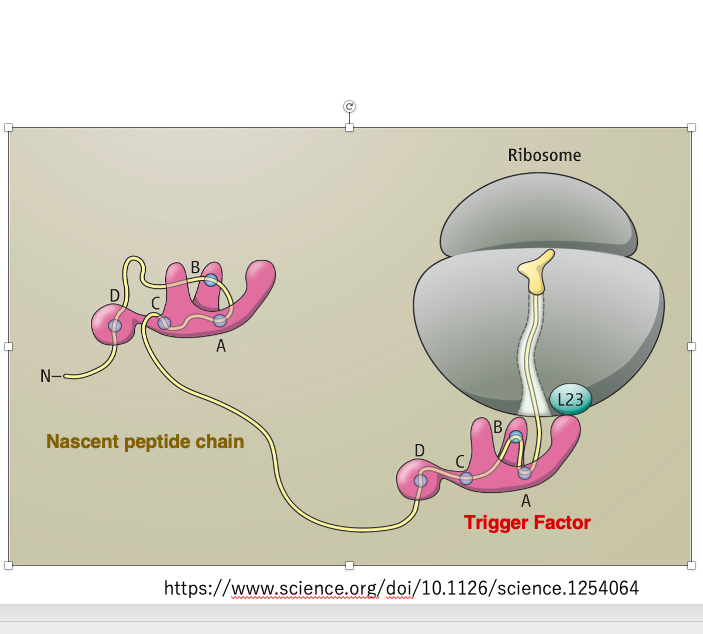
リボソームのラージサブユニットから合成されつつあるたんぱくのN-末端が頭を出すと,まずそれに取り付くシャペロン分子として、トリガーファクターが知られています。
トリガーファクターができつつある新生ペプチド鎖に付着することによって、疎水性の部分が内側に親水性の部分が外側になるような折りたたみが始まります。また、新生ペプチド鎖が長くなるにつれて、2番目のトリガーファクターが付着して,更なる折り畳みを介助します。
このように,シャペロン分子の一種である,トリガーファクターを使ったタンパクの折りたたみが,新生タンパクの合成初期から始まります。
20. GroEL/GroES Chaperonin: 変性したタンパクの折り畳み直しに使われるシャペロニン
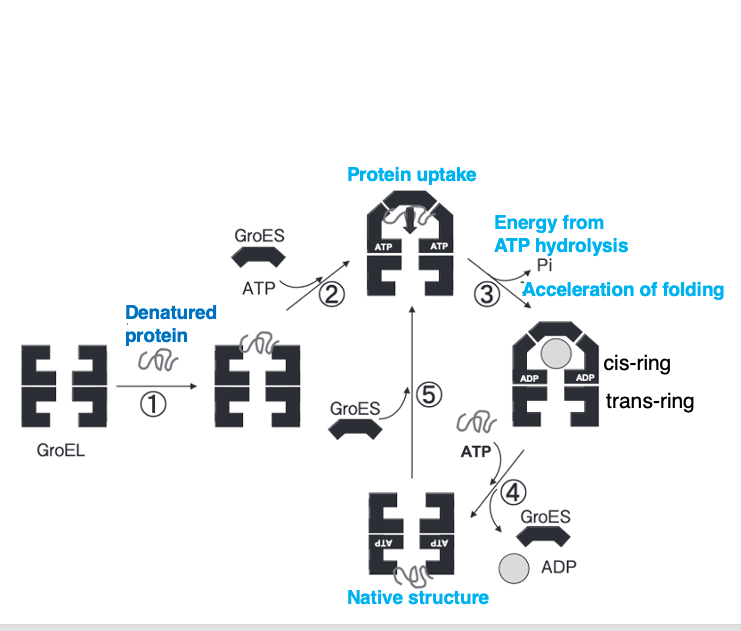
大腸菌の中ではグローELとグローESという2つのシャペロンタンパクの複合体が, 新生タンパクの折り畳み補助や変性タンパクの折り畳みのやり直しに使われています。グローELとグローESの複合体は,シャペロン分子の中でも特にシャペロニンというふうに呼ばれることが多いです。
グローEL内に変性タンパクが取り込まれていきます。 変性タンパクがグローELの中に入ると, グローESがグローELで作られた容器に蓋をしていきます。 この空間の中でATPを使って,変性したタンパク, あるいはまだ正しい立体構造を作っていない 新生タンパクが,正しくフォルディングされます。
タンパクが 正しくフォルディングされると,グローESのキャップが離れて,グローELからタンパクが放出されます。
21. Proteasome-Ubiquitin系: 修正不能なタンパクの分解除去装置
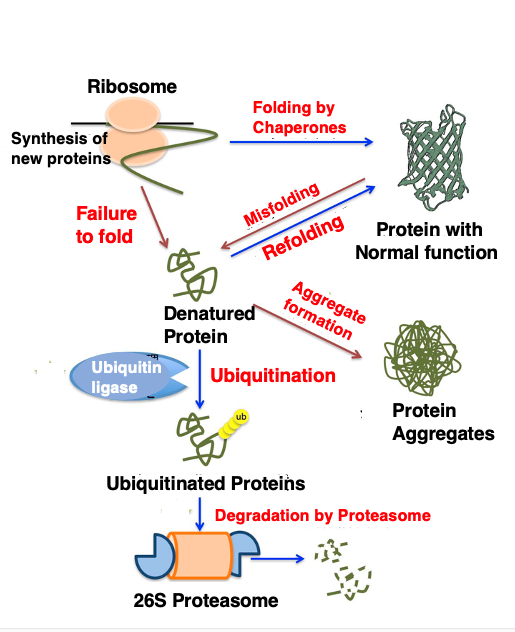
これまで説明してきましたように, 細胞の中では新生タンパクをシャペロンを使って正しく折りたんだり,立体構造が歪んでしまったタンパクを シャペロンによって折りたたみ直そうとするような努力が行われるわけですが, それでも変性タンパクがどうしても正しく折りたたまれないような場合,そのような立体構造が正しくないものが集まって凝集塊を形成する場合があります。
また,この凝集塊は,細胞にとって有害な作用を及ぼす場合があります。神経細胞内に蓄積したタンパクの凝集塊が原因で,アルツハイエマー病やハンチントン病が引き起こされる場合があります。
細胞では,それを防ぐために,正しく折りたたみ直すことができないタンパクには, ユビキチンと呼ばれる小さなペプチドの標識をつけて,これらのタンパクをプロテアソームと呼ばれる大きなタンパクの分解装置に送り込み,そこで分解しています。
これでタンパクの立体構造に関する説明を終わります。
コメント